
【题目】如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,②是工业上重要的反应之一。
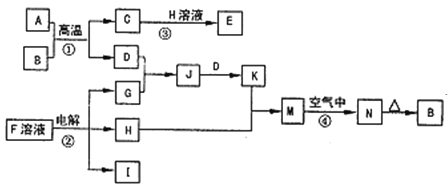
请回答下列问题:
(1)H的电子式是___,其中含有的化学键类型是___。
(2)写出反应④的现象:___,有关反应的化学方程式为___。
(3)已知I的燃烧热是-285.8kJmol-1,则1m3(标准状况)I完全燃烧,恢复至室温时放出的热量是__(计算结果保留3位有效数字)。
(4)25℃时,以Pt为电极电解含有少量酚酞的F的饱和溶液,则在___(填“阴”或“阳”)极附近溶液由无色变为红色,若在此极收集到0.2g气体,则此时溶液的pH是__(假设溶液的体积为2L且不考虑电解后溶液体积的变化)。
(5)在K溶液中加入与K等物质的量的Na2O2,恰好使K转化为N。写出该反应的离子方程式:___。
【答案】![]() 离子键和共价键 白色沉淀迅速转化为灰绿色,最后变化为红褐色沉淀 4Fe(OH)2+O2+2H2O=4Fe(OH)3 1.28×104kJ 阴 13 4Fe2++4Na2O2=4Fe(OH)3↓+O2↑+8Na+
离子键和共价键 白色沉淀迅速转化为灰绿色,最后变化为红褐色沉淀 4Fe(OH)2+O2+2H2O=4Fe(OH)3 1.28×104kJ 阴 13 4Fe2++4Na2O2=4Fe(OH)3↓+O2↑+8Na+
【解析】
反应①常被应用于野外焊接钢轨,应为金属铝和氧化铁发生铝热反应,方程式为:Fe2O3+2Al![]() 2Fe+Al2O3,结合N加热生成B分析判断,则A为Al,B为Fe2O3,反应②是工业上重要的反应之一,分析流程图可知,H为溶液和铝热反应生成的C发生反应,说明H为NaOH,C为Al2O3,D为Fe,G为Cl2;J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,N为红褐色固体,应为Fe(OH)3,反应②是电解F溶液应为NaCl溶液,电解生成NaOH、H2和Cl2气体,则D应为Fe,C为Al2O3,H为NaOH,G为Cl2,J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,I为H2;
2Fe+Al2O3,结合N加热生成B分析判断,则A为Al,B为Fe2O3,反应②是工业上重要的反应之一,分析流程图可知,H为溶液和铝热反应生成的C发生反应,说明H为NaOH,C为Al2O3,D为Fe,G为Cl2;J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,N为红褐色固体,应为Fe(OH)3,反应②是电解F溶液应为NaCl溶液,电解生成NaOH、H2和Cl2气体,则D应为Fe,C为Al2O3,H为NaOH,G为Cl2,J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,I为H2;
(1)、分析判断H为NaOH.电子式为:![]() ,氢氧化钠中含有离子键和共价键,故答案为:
,氢氧化钠中含有离子键和共价键,故答案为:![]() ;离子键和共价键;
;离子键和共价键;
(2)、反应④为氢氧化亚铁被空气中的氧气氧化为氢氧化铁的过程,反应现象为白色沉淀迅速转化为灰绿色最后变化为红褐色沉淀,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:白色沉淀迅速转化为灰绿色最后变化为红褐色沉淀;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)、已知I为H2的燃烧热是-285.8kJmol-1,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,则1m3(标准状况)H2物质的量=![]() ,完全燃烧,恢复至室温时放出的热量=
,完全燃烧,恢复至室温时放出的热量=![]() ×285.8kJ/mol=1.28×10-4kJ,故答案为:1.28×10-4kJ;
×285.8kJ/mol=1.28×10-4kJ,故答案为:1.28×10-4kJ;
(4)、25℃时,以Pt为电极电解含有少量酚酞的F为NaCl的饱和溶液,阳极电极反应为2Cl--2e-=Cl2↑,阴极电极反应为2H++2e-=H2↑,阴极负附近氢离子浓度减小,氢氧根离子浓度增大,溶液呈红色;若在此极收集到0.2g气体,即生成氢气物质的量为0.1mol,转移电子为0.1mol,所以溶液中增加氢氧根离子物质的量为0.2mol,溶液体积为2L,溶液中氢氧根离子浓度为0.1mol/L,则此时溶液的pH=13,故答案为:阴;13;
(5)、在K为FeCl2溶液中加入与FeCl2等物质的量的Na2O2,恰好使K转化为N为Fe(OH)3,依据氧化还原反应电子守恒和原子守恒写出反应的离子方程式为:4Fe2++4Na2O2=4Fe(OH)3↓+O2↑+8Na+,故答案为:4Fe2++4Na2O2=4Fe(OH)3↓+O2↑+8Na+。


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】有机物H是合成某种药物的中间体,一种合成路线如图:
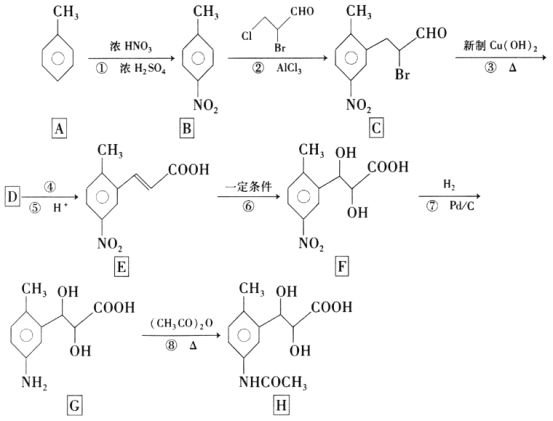
回答下列问题:
⑴有机物F的分子式为___,反应⑦的反应类型为___。
⑵分别出反应反应②和③的化学方程式___。
⑶1molE与1molH2完全加成生成1molW,W有多种同分异构体,其中属于α-氨基酸、分子中含两个羧基、且苯环上有两个取代基的W的可能结构共有___种(不考虑立体异构),其中核磁共振氢谱为五组峰,峰面积比为3:2:2:2:2的结构简式为___。
⑷设计以甲苯和(CH3CO)2O为原料制备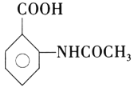 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按要求表示下列有机物:
①相对分子质量为72且沸点最低的烷烃的结构简式:____。
②顺-2-丁烯的结构简式:____________。
③某炔烃经催化加氢后可得到2-甲基丁烷,则该炔烃的名称是(按系统命名法命名):______。
(2)某有机物X分子中只含C、H、O三种元素,相对分子质量小于110,其中氧元素的质量分数为14.8%。已知该物质可与FeCl3溶液发生显色反应,则X的分子式为_____;若1molX与浓溴水反应时可消耗3molBr2,则X的结构简式为_____。
(3)按要求写出下列反应的化学方程式:
①实验室制备乙炔的化学方程式:__________。
②2-溴丙烷与氢氧化钠水溶液共热的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C—C键可以绕键轴自由旋转,结构简式如下的烃,下列说法中正确的是( )
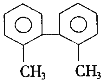
A.分子中至少有8个碳原子处于同一平面上
B.分子中至少有9个碳原子处于同一平面上
C.该烃的一氯取代物最多有8种
D.该烃是苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
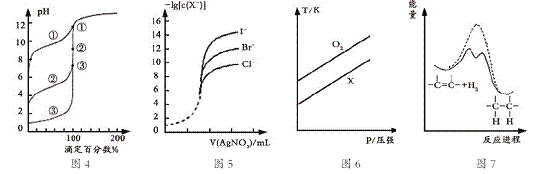
A.用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由图4曲线确定①的酸性最强
B.用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/L Cl-、Br-及I-的混合溶液,由图5曲线,可确定首先沉淀的是Cl-
C.在体积相同的两个密闭容器中,分别充入相同质量O2和X气体,由图6可确定X可能是CH4气体
D.由图7可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3 具有净水作用,请回答下列问题:
(1)FeCl3净水的原理是_____________(用离子方程式表示)。
(2)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入_____。
(3)工业上由CuCl2·2H2O晶体制备无水CuCl2的合理方法是在HCl气氛中加热,若在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是_________ (用化学方程式表示)。
(4)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:①取0.36 g试样溶于水,加入过量KI固体,发生反应:2Cu2++4I- = 2CuI↓+I2,生成白色沉淀。②用0.100 0 mol·L-1Na2S2O3标准溶液滴定生成的I2,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。(已知:I2+2S2O32- = S4O62-+2I-)
①滴定过程可选用________作指示剂,滴定终点时的现象是_______________________。
②该试样中CuCl2·2H2O的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一种钯催化的交叉偶联反应可以表示为:

硝基还原为氨基: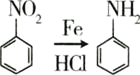
下面是利用钯催化的交叉偶联反应,以烯烃A(含两个甲基)与苯为原料合成L(相对质量不超过200)的过程,其中F在浓硫酸作用下可以发生两种不同的反应分别形成H和G。

(1)写出反应的反应类型:④___⑥___。
(2)写出反应需要的无机反应物、反应条件:①___⑤___;
(3)J中所含官能团的名称__,__。
(4)根据要求完成下列两个空格:
用系统命名法给物质A命名:__;写出物质L的结构简式:__。
(5)写出下列反应的化学方程式:
C→D:___。
D与新制的Cu(OH)2__。
F→G:___。
(6)H有多种同分异构体,请写出一种符合下列条件的结构简式:__。
ⅰ.能发生水解反应
ⅱ.分子中只含有两个甲基
ⅲ.不含环状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油中的一种成分(结构如图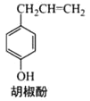 所示),关于胡椒酚的下列说法:
所示),关于胡椒酚的下列说法:
①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面内;
③它不能与烧碱发生反应;④1mol该化合物最多可与3molBr2发生反应。
其中正确的是( )
A.①③B.②④C.①②④D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com