
【题目】中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银铜合金切割废料中回收银并制备铜化工产品的工艺如下:
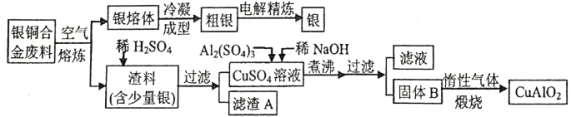
注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为___________。
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为___________(写出两种)。
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为______________________。
(4)过滤操作需要的玻璃仪器除烧杯外还有___________。
(5)固体混合物B的组成为___________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为___________。
(6)煅烧阶段通入惰性气体的原因___________。
【答案】粗银 拌、渣料粉碎、适当升温、适当增大H2SO4的浓度或其它合理答案 3Ag + 4H+ + NO3- = 3Ag+ + NO↑ + 2H2O 漏斗、玻璃棒 Al(OH)3和CuO的混合物 Al(OH)3+OH-=AlO2—+2H2O 保护气(或防止铜被氧化)
【解析】
银铜合金在空气中熔炼,渣料中含有氧化铜和少量的银,加入稀硫酸,过滤后得到硫酸铜溶液,在硫酸铜溶液中加入硫酸铝和稀氢氧化钠溶液,煮沸、过滤得到Al(OH)3和CuO的混合物,煅烧可得到CuAlO2,据此答题。
(1)电解精炼铜时,纯铜作阴极,粗铜作阳极,硫酸铜溶液作电解液,电解精炼银与此类似,则纯银作阴极,粗银作阳极,硝酸银溶液作电解液,故答案为:粗银。
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施有搅拌、渣料粉碎、适当升温、适当增大H2SO4的浓度或其它合理答案,故答案为:搅拌、渣料粉碎、适当升温、适当增大H2SO4的浓度或其它合理答案。
(3)滤渣A的主要成分是Ag,稀硝酸是氧化性酸,能溶解银、产生无色气体,即3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O,离子方程式为:3Ag+4H+ +NO3-=3Ag++NO↑+2H2O,无色的一氧化氮气体在空气迅速被氧化为红棕色的二氧化氮气体,即2NO+O2=2NO2;故答案为:3Ag+4H+ +NO3-=3Ag++NO↑+2H2O。
(4)过滤操作需要的玻璃仪器有烧杯、漏斗、玻璃棒,故答案为:漏斗、玻璃棒。
(5)结合信息和流程图可知:硫酸铜、硫酸铝与稀氢氧化钠溶液反应生成氢氧化铜和氢氧化铝,煮沸是氢氧化铜分解生成氧化铜,氢氧化铝不分解,所以固体B的主要成分是Al(OH)3和CuO的混合物,若NaOH过量,两性氢氧化物Al(OH)3就会溶解,反应氮的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3和CuO的混合物;Al(OH)3+OH-=AlO2-+2H2O。
(6)煅烧阶段通入惰性气体的原因是做保护气(或防止铜被氧化),故答案为:保护气(或防止铜被氧化)。


科目:高中化学 来源: 题型:
【题目】甲池是乙醇燃料电池,电解乙池硝酸银溶液。M、N两个电极均为石墨电极,请回答下列问题:
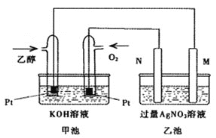
![]() 甲池中乙醇电极名称是______,
甲池中乙醇电极名称是______,![]() 填正极或负极
填正极或负极![]() ,通
,通![]() 的铂电极反应式为_______。一段时间后,该池pH_______
的铂电极反应式为_______。一段时间后,该池pH_______![]() 填增大、减小、不变
填增大、减小、不变![]() 。
。
![]() 乙池中溶液中
乙池中溶液中![]() 的向______极
的向______极![]() 填M或
填M或![]() 移动,在此过程中,乙池中某极析出金属
移动,在此过程中,乙池中某极析出金属![]() 时,甲池中理论上消耗氧气为______
时,甲池中理论上消耗氧气为______![]() 标准状况下
标准状况下![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) ![]() Ca2+(aq)+2OH-(aq)。下列说法正确的是( )
Ca2+(aq)+2OH-(aq)。下列说法正确的是( )
A.恒温下向溶液中加入CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列有关叙述正确的是( )
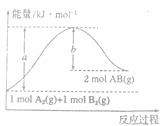
A.每生成2molAB(g)吸收bkJ热量
B.该反应中反应物的总能量高于生成物的总能量
C.反应热ΔH=+(a-b)kJ/mol
D.形成1molA-A键和1mo1B-B键,吸收akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.在含有![]() 沉淀的溶液中加入
沉淀的溶液中加入![]() 固体,
固体,![]() 增大
增大
C.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
D.物质的溶解度随温度的升高而增加,物质的溶解都是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
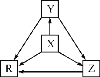
选项 | X | Y | Z | R |
A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
B | Na | Na2O | Na2O2 | NaOH |
C | H2S | S | SO2 | SO3 |
D | N2 | NH3 | NO | NO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g) + B(g) ![]() xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
A. x=1
B. B的转化率为50%
C. 2min内A的反应速率为0.3mol·L-1·min-1
D. 若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是阿伏加德罗常数的值。下列说法正确的是
是阿伏加德罗常数的值。下列说法正确的是![]()
A.![]() 标准状况
标准状况![]() 和NO的混合物中含有的分子数为
和NO的混合物中含有的分子数为![]()
B.1mol羟基与1mol氢氧根离子含有的电子数均为![]()
C.![]() g
g![]() 完全水解形成的
完全水解形成的![]() 胶体粒子数为
胶体粒子数为![]()
D.42g乙烯和丁烯的混合物中含有的极性共价键数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.2.24L(标准状况下)苯在O2中完全燃烧,得到0.6NA个CO2分子
B.1mol乙酸(忽略挥发损失)与足量的C2H518OH在浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5分子
C.14g乙烯和丙烯混合气体中的氢原子数为2NA
D.标准状况下,11.2LCCl4中含分子数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com