
【题目】下列说法正确的是
A.常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.在含有![]() 沉淀的溶液中加入
沉淀的溶液中加入![]() 固体,
固体,![]() 增大
增大
C.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
D.物质的溶解度随温度的升高而增加,物质的溶解都是吸热的
科目:高中化学 来源: 题型:
【题目】某课外小组分别用下图所示装置对原电池和电解原理进行实验探究.
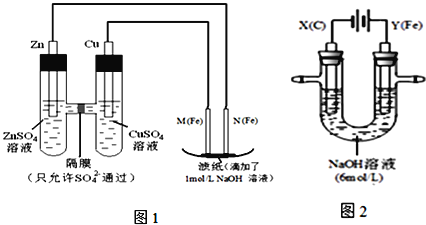
请回答:
I.用图1所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是______(填字母序号).
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为_____________.
(3)实验过程中,SO42-______(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有______________.
II.用图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(4)电解过程中,X极区溶液的pH______(填“增大”、“减小”或“不变”).
(5)电解过程中,Y极发生的电极反应为_____________和4OH-- 4e-= 2H2O + O2↑
(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少______g.
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 该电池正极发生的反应的电极反应式为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐
B.已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.01%
C.0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液等体积混合,则溶液中: 2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-)
D.在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业生产上中,主要用Na2SO3制造亚硫酸纤维素酯、硫代硫酸钠、有机化学药品、漂白织物等。但Na2SO3在空气中易氧化为Na2SO4而变质。为了求出变质样品中Na2SO3的含量,采用0.2 mol·L-1KMnO4酸性溶液滴定用样品配制的溶液。反应离子方程式是:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O,称取20 g样品,配成250 mL溶液,量取25 mL进行滴定,记录数据,再重复2次实验。
填空完成问题:
(1)滴定实验不需要下列仪器中的________。
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL) C.量筒(10 mL) D.锥形瓶 E.铁架台 F.滴定管夹
G.白纸 H.玻璃棒
(2)已知滴定过程不需要指示剂,理由是_______________________。
(3)下列操作中可能使所测Na2SO3溶液的浓度数值偏低的是________(填字母)。
A.盛放Na2SO3溶液的滴定管没有使用Na2SO3溶液润洗
B.锥形瓶内有水残留,没有烘干,装入待测的Na2SO3溶液滴定
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
(4)滴定完毕,三次实验平均消耗0.2 mol·L-1KMnO4酸性溶液20.00mL,则样品中Na2SO3的百分含量为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列关于有机实验的问题。
(1)甲同学进行淀粉水解实验,为了检验淀粉水解的产物,设计如下实验方案:
![]()
①试剂1为20%的H2SO4溶液,其作用是__________________________。
②有同学忘记加试剂2,在实验最后没有看到砖红色的现象,原因是__________________。
③若要检验淀粉是否完全水解,在_______(填图中框内物质)中加入_______(填试剂名称)试剂。
(2)乙同学进行苯的硝化反应。实验流程如图顺序。已知:硝基苯沸点为210℃,蒸馏分离时选用空气冷凝管。
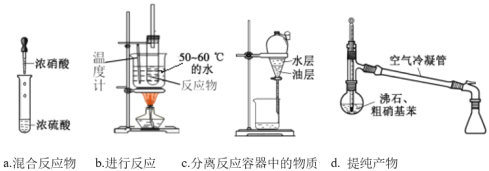
①写出苯的硝化反应的方程式:_______。
②d的蒸馏操作中加入沸石的作用是_______。
③上述操作或者装置中有错误的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银铜合金切割废料中回收银并制备铜化工产品的工艺如下:
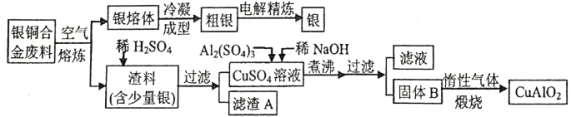
注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为___________。
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为___________(写出两种)。
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为______________________。
(4)过滤操作需要的玻璃仪器除烧杯外还有___________。
(5)固体混合物B的组成为___________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为___________。
(6)煅烧阶段通入惰性气体的原因___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着工业的迅速发展,废水的种类和数量迅猛增加,对水体的污染也日趋广泛和严重,威胁人类的健康和安全.因此工业废水的处理是当代一个重要的课题.

![]() 臭氧是一种强氧化剂,在处理含氰
臭氧是一种强氧化剂,在处理含氰![]() 废水过程中由于无二次污染,而备受关注.该过程由两步反应组成:
废水过程中由于无二次污染,而备受关注.该过程由两步反应组成:![]()
总反应的化学方程式为 ______ ,该反应![]() ______ .
______ .
![]() 工业含磷废水中含大量的
工业含磷废水中含大量的![]() ,可通过投放镁盐进行除磷.
,可通过投放镁盐进行除磷.
![]() 投放的镁盐让磷酸根形成
投放的镁盐让磷酸根形成![]() 沉淀而除磷.如图1显示,沉淀过程的 pH 对废水中磷的去除率影响很大.从如图可知,最佳除磷的pH范围是 ______
沉淀而除磷.如图1显示,沉淀过程的 pH 对废水中磷的去除率影响很大.从如图可知,最佳除磷的pH范围是 ______ ![]() 当pH较高时,磷去除率下降的原因是 ______ .
当pH较高时,磷去除率下降的原因是 ______ .
![]() 若处理后的废水中
若处理后的废水中![]() 时,试计算溶液中的
时,试计算溶液中的![]() 写出计算过程,已知
写出计算过程,已知![]()
![]() 若废水中还含有大量的
若废水中还含有大量的![]() ,投放镁盐,可得到磷酸氨镁晶体
,投放镁盐,可得到磷酸氨镁晶体![]() ,可用作化肥.写出该反应的离子方程式 ______ .
,可用作化肥.写出该反应的离子方程式 ______ .
![]() 实验表明,其他条件相同时学科王,温度越高,残余磷浓度越高.已知
实验表明,其他条件相同时学科王,温度越高,残余磷浓度越高.已知![]() 时,
时,![]() 反应时间t的变化曲线如图
反应时间t的变化曲线如图![]() 若保持其他条件不变,请在坐标图中,画出
若保持其他条件不变,请在坐标图中,画出![]() 时
时![]() 反应时间t的变化曲线示意图。
反应时间t的变化曲线示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在探究废干电池内的黑色固体回收利用时,进行了如图所示实验:

查阅教材可知,普通锌锰干电池中的黑色物质的主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作②的名称是__。
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、__和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为__。
(3)操作④的试管中加入操作③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色滤渣中含有__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com