
����Ŀ����ش����й����л�ʵ������⡣
��1����ͬѧ���е���ˮ��ʵ�飬Ϊ�˼������ˮ��IJ���������ʵ�鷽����
![]()
���Լ�1Ϊ20%��H2SO4��Һ����������__________________________��
����ͬѧ���Ǽ��Լ�2����ʵ�����û�п���ש��ɫ������ԭ����__________________��
����Ҫ��������Ƿ���ȫˮ�⣬��_______����ͼ�п������ʣ��м���_______�����Լ����ƣ��Լ���
��2����ͬѧ���б���������Ӧ��ʵ��������ͼ˳����֪:�������е�Ϊ210�����������ʱѡ�ÿ��������ܡ�
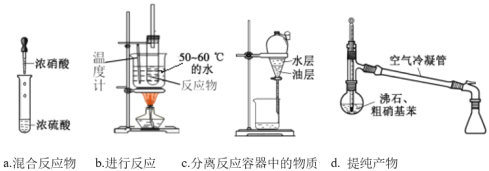
��д������������Ӧ�ķ���ʽ��_______��
��d����������м����ʯ��������_______��
��������������װ�����д������_______��
���𰸡������� û���к������������� ˮ��Һ ��ˮ ![]() ��ֹ���� ad
��ֹ���� ad
��������
��������ͼ���Լ�1ΪH2SO4��Һ���ɴ�����ˮ�⣬�Լ�2ΪNaOH���ɽ���Һ��Ӧ�����ԣ��ټ������Ƶ�������ͭ�������������Ƿ�Ӧ����ש��ɫ��Cu2O������
��1���ٸ��ݷ�����20%��H2SO4��Һ���������ã�
����û�м�NaOH����һ���ӵ�H2SO4��������Һ�У�����������Ƶ�������ͭ����H2SO4��Ӧ�������������Ƿ�Ӧ����������ש��ɫ������
����Ҫ��������Ƿ���ȫˮ�⣬�Ϳ�ˮ��Һ���Ƿ�ʣ����ۣ�����һ���õ���飬������ˮ��Һ�м����ˮ��
��2���ٱ���������Ӧ�DZ���Ũ����Ĵ�����Ũ����ķ�Ӧ������ʽΪ��![]() ��
��
�����ڷ�Ӧ�ﶼ��Һ̬��Ϊ��ֹ���Ȳ������������У�������ʯ��
��a��Ũ������Ũ�����ϻ�ų��������ȣ��罫Ũ�������Ũ�����У�������ܶ�С��Ũ���ᣬ����Ϊ����Һ�������a����
b����Ӧ��50��C ~ 60��C�½��У�����ˮ�ķе㣬��˿�������ˮԡ���ȿ��ƣ�������ʹ��Ӧ�������Ⱦ��ȣ����ڿ����¶ȣ�b��ȷ��
c��������Ϊ��״Һ�壬������ˮ���ܶȱ�ˮ�����²㣬��Һ����ʱӦ����Һ©���Ͽڵ�ƿ�����¶˽����ձ��ڱڣ��²��Һ����¿ڷų���c��ȷ��
d����������ᴿ�������¶ȼ����������������¶ȣ���������������ʵ��¶ȣ��¶ȼ�ˮ����Ӧ����ƿ��֧�ܿڴ���d����
��ѡad��


 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�����û�ѧƽ���ƶ�ԭ�����͵���(����)
A.��AgCl��Һ�м�������KI��Һ���ɿ�����ɫ������Ϊ��ɫ����
B.��ѹ�ȳ�ѹ��������N2��H2ת��ΪNH3
C.����AlCl3��Һ���õ���ˮAlCl3
D.�μ�����CuSO4��Һ���Լӿ�Zn��ϡH2SO4��Ӧ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��A�������ܶ�����ͬ״���������ܶȵ�36������֪������̼����Ԫ�ص�������Ϊ5:1���ش��������⣺
��1����������Է�������Ϊ__________________��
��2�������ķ���ʽΪ__________________��
��3��������____________�ֽṹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A. �����£�10 mL 0.02 mol��L��1 HCl��Һ��10 mL 0.02 mol��L��1 Ba(OH)2��Һ��ֻ�ϣ�����Ϻ���Һ�����Ϊ20 mL������Һ��pH��12
B. ��0.1 molL��1 CH3COONa��Һ�У�n(OH��)+0.1mol��n(CH3COOH)+n(H+)+n(Na+)
C. ��10mL 0.1 mol/L��AgNO3��Һ�м���6mL��Ũ�ȵ�NaCl��Һ���а�ɫ�����������ټ���6 mL��Ũ�ȵ�Na2S��Һ����Һ�����к�ɫ�������ɣ�˵��Ksp��Ag2S��< Ksp��AgCl��
D. ������pH=4��NaHC2O4��Һ��:c(H2C2O4)>c(C2O42��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����У�ͬʱ�����Ӽ������Թ��ۼ��ͷǼ��Թ��ۼ��Ķ��Ѻ��γɵķ�Ӧ�ǣ�������
A.NH4Cl![]() NH3����HCl��B.2Na2O2��2CO2=2Na2CO3��O2
NH3����HCl��B.2Na2O2��2CO2=2Na2CO3��O2
C.2NaOH��Cl2=NaCl��NaClO��H2OD.NH3��CO2��H2O=NH4HCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.��������AgClˮ��Һ�м������ᣬKspֵ���
B.�ں���![]() ��������Һ�м���
��������Һ�м���![]() ���壬
���壬![]() ����
����
C.��ϡ����ϴ��AgCl��������ˮϴ�����AgClС
D.���ʵ��ܽ�����¶ȵ����߶����ӣ����ʵ��ܽⶼ�����ȵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ��һ����Ҫ����Ȼ��Դ���������������治��ȱ�ٵ����ʣ�ˮ������ֱ��Ӱ�����彡������ش��������⣺
��1��ijƶ��ɽ����Ϊ��Ѱ�Һ��ʵ�����ˮ����ɽ�ϵ�Ȫˮ�����˷������飬�����ʾ��ˮ����Ҫ��Ca2+��Mg2+��Cl����SO42�������Ӳˮ����_____(������ʱ������������)Ӳ�ȣ���Ҫ��ȥCa2+��Mg2+��������ˮ�м���ʯ�Һʹ���Լ�����ʱ�ȼ�______���___________��
��2���ҹ��涨����ˮ��Ӳ�Ȳ��ܳ���25�ȣ�Ӳ�ȵı�ʾ�����ǣ���ˮ�е�Ca2+��Mg2+������Ca2+�������������CaO��������ͨ����1��ˮ�к���10mg CaO��Ϊ1�ȣ�ij��ѧʵ��С��Ա���������ˮ��Ӳ�Ƚ��м�⡣
ʵ�����漰�IJ��ַ�Ӧ��
M2+(��������)+EBT��(����T)�TMEBT+
��ɫ �ƺ�ɫ
M2+(��������)+Y4��(EDTA)�TMY2��
MEBT++Y4��(EDTA)�TMY2��+EBT��(����T )
ʵ����̣�
��ȡ����ˮ��Ʒ25.00mL����Ԥ������д����Mg2+�������ʱӲ�ȵ�ˮ�ü��ȷ�������ʱ��������Ӧ�Ļ�ѧ����ʽ��_______________��
��Ԥ�����ķ�������ˮ���м���Ũ���ᣬ��м����ӣ���е�Ŀ����______________��
�����������ˮ��ת�Ƶ�250mL����ƿ�У����백ˮ���Ȼ�炙�����Һ����pHΪ10���μӼ��θ���T��Һ����0.010 00molL��1��EDTA����Һ���еζ����ζ��յ�ʱ������EDTA��Һ15.00mL����õ���ˮ��Ӳ��Ϊ________________��
��3��ij��ҵ��ˮ�к���CN����Cr2O72�������ӣ��辭��ˮ������������ŷţ���ˮ�����������������̽��д�����
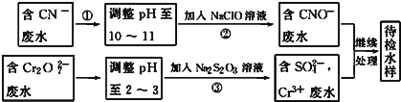
�ش��������⣺
���������У���Ӧ��������ų����÷�Ӧ�����ӷ���ʽΪ______________________��
����Cr3+��ˮ���һ���������������һ������������________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����![]()
A.��Ӧ��![]() ���¶�Ϊ298Kʱ���Է����У�������
���¶�Ϊ298Kʱ���Է����У�������![]() ��
��![]()
B.![]()
![]() ��Һ������ˮϡ�ͣ���Һ��pH���ϼ�С
��Һ������ˮϡ�ͣ���Һ��pH���ϼ�С
C.Ǧ���طŵ�ʱ����������������������
D.���º��������¿��淴Ӧ��![]() ����ƽ�������ƽ����ϵ�м���һ������A����ƽ����ϵ�У�B�����ʵ�������һ������
����ƽ�������ƽ����ϵ�м���һ������A����ƽ����ϵ�У�B�����ʵ�������һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�������ֵΪNA������˵����ȷ����(����)
A. 1 L 0.1 mol��L��1 NH4Cl��Һ�У�NH4+������Ϊ0.1NA
B. 1mol Na2O2��������ˮ��Ӧ��ת�Ƶĵ�����Ϊ2NA
C. ��״���£�2.24 L N2��O2�Ļ�������з�����Ϊ0.2NA
D. 0.1 mol H2��0.1 mol I2���ܱ������г�ַ�Ӧ�����������Ϊ0.2NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com