
【题目】阿伏加德罗常数的值为NA。下列说法正确的是( )
A. 1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数量为0.1NA
B. 1mol Na2O2与足量的水反应,转移的电子数为2NA
C. 标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
D. 0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
【答案】D
【解析】
A.因在水溶液中铵根离子会发生水解,则1 L 0.1 mol·L-1 NH4Cl溶液中NH4+的数量小于0.1NA,故A错误;
B. Na2O2与足量的水反应为2Na2O2+2H2O=4NaOH+O2↑,通过氧元素化合价的分析可得关系式:2Na2O2——2e-,则1mol Na2O2与足量的水反应转移的电子数为NA,故B错误;
C.标准状况下,2.24 L N2和O2的混合气体的物质的量为0.1mol,其分子数应为为0.1NA,故C错误;
D. H2+I2![]() 2HI这是一个反应前后分子物质的量不变的反应,故反应容器中气体的物质的量始终为0.2mol,分子数目为:0.2NA,故D正确;
2HI这是一个反应前后分子物质的量不变的反应,故反应容器中气体的物质的量始终为0.2mol,分子数目为:0.2NA,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种主要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组就此粉末为原料回收铈,设计实验流程如下:
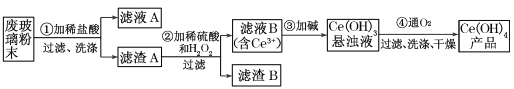
(1)洗涤滤渣A的目的是为了除去_____________(填离子符号),检验该离子是否洗净的方法是________________。
(2)第②步反应的离子方程式是___________________,滤渣B的主要成分是___________。
(3)萃取是分离稀士元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP_______(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有___________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.1000 mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准维液,该产品中Ce(OH)4的质量分数为_______________(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不法分子有时用铜锌合金制成假金币行骗。下列方法中,不能有效鉴别真假的是
A. 在空气中灼烧看表面是否变黑
B. 利用阿基米德原理测密度
C. 用手掂量轻重
D. 滴一滴硝酸在金币的表面,观察现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了如下装置用于制取 SO2 和验证 SO2 的性质。
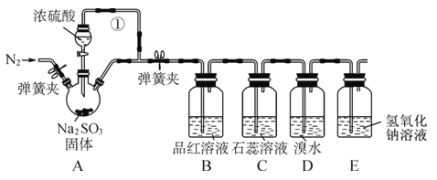
试回答以下问题:
(1)装置 A 中反应的化学方程式为___________________________________。
(2)导管①的作用是___________________,最左侧通N2的主要作用是___________________
(3)装置 B 中的现象体现出 SO2 _______________性。
(4)装置 D 中溴水褪色,体现出 SO2 _________________性。
(5)E 装置的作用是 ______________,发生反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所示装置正确且能完成相关实验的是( )
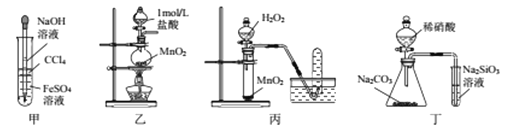
A. 用甲所示装置制取并观察Fe(OH)2 B. 用乙所示装置制取少量Cl2
C. 用丙所示装置制取O2 D. 用丁所示装置比较N、C、Si的非金属性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂的保存方法中错误的是( )
A.少量的钠保存在煤油中
B.NaOH溶液保存在带玻璃塞的试剂瓶中
C.新制的氯水保存在棕色试剂瓶中
D.FeSO4溶液保存在有少量铁粉的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂醛F (![]() )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
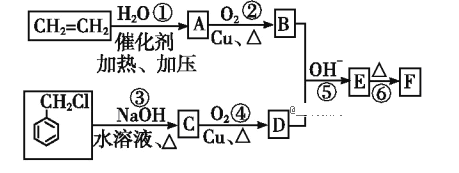
已知:两个醛分子在NaOH溶液作用下可以发生反应,生成一种羟基醛:
![]() +
+ ![]()
![]()
![]()
请回答:
(1)D的名称为__________________。
(2)反应①~⑥中属于加成反应的是___________(填序号)。
(3)写出反应③的化学方程式:______________________________________;
反应④的化学方程式:_________________________________________。
(4)在实验室里鉴定![]() 分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是__________(请按实验步骤操作的先后次序填写序号)。
分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是__________(请按实验步骤操作的先后次序填写序号)。
A.滴加AgNO3溶液 B.加NaOH溶液 C.加热 D.用稀硝酸酸化
(5)E的同分异构体有多种,其中之一甲属于酯类。甲可由H(已知H的相对分子量为32)和芳香酸G制得,则甲的结构共有__________种。
(6)根据已有知识并结合相关信息日,写出以乙烯为原料制备CH3CH=CHCHO的合成路线流程图(无机试剂任选)。合成路线流程图例如下:_____________________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】云阳龙缸云端廊桥曾被詟为“世界第一悬挑玻璃景观廊桥”,所用钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制.
(1)基态硫原子价层电子的轨道表达式(电子排布图)为_____________________
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___________晶体,Ni(CO)4
空间构型与甲烷相同,中心原子的杂化轨道类型为___________,写出与配体互为等电子体的阴离子________________________(任写一种).
(3)黄血盐[K4Fe(CN)63H2O]中,三种同周期非金属元素第一电离能由小到大顺序为_________________。
(4)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱 > (填化学式),_________,理由是________________________________________________________.
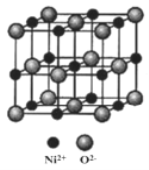
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为________________g/cm3(只列出计算式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com