
【题目】云阳龙缸云端廊桥曾被詟为“世界第一悬挑玻璃景观廊桥”,所用钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制.
(1)基态硫原子价层电子的轨道表达式(电子排布图)为_____________________
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___________晶体,Ni(CO)4
空间构型与甲烷相同,中心原子的杂化轨道类型为___________,写出与配体互为等电子体的阴离子________________________(任写一种).
(3)黄血盐[K4Fe(CN)63H2O]中,三种同周期非金属元素第一电离能由小到大顺序为_________________。
(4)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱 > (填化学式),_________,理由是________________________________________________________.
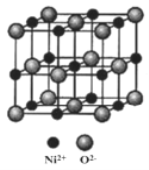
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为________________g/cm3(只列出计算式).
【答案】![]() 分子晶体sp3杂化CN- 或C22-C <O< NH2SeO4>H2SeO3因为H2SeO4中非羟基氧数目比H2SeO3多,使得H2SeO4中羟基氢更易电离,故H2SeO4酸性更强
分子晶体sp3杂化CN- 或C22-C <O< NH2SeO4>H2SeO3因为H2SeO4中非羟基氧数目比H2SeO3多,使得H2SeO4中羟基氢更易电离,故H2SeO4酸性更强![]()
【解析】
(1)S原子核外有16个电子,分别位于1s、2s、2p、3s、3p轨道,价电子位于3s、3p轨道,则基态硫原子价层电子的轨道表达式为![]() ,
,
故答案为:![]() ;
;
(2)根据相似相溶原理判断,Ni(CO)4溶于乙醇、CCl4、苯等有机溶剂,所以可判断Ni(CO)4为分子晶体,Ni(CO)4空间构型与甲烷相同,甲烷为正四面体,中心原子为sp3杂化,所以可判断中心原子的杂化轨道类型为sp3杂化;等电子体是指原子总数相同,价电子总数相同的微粒,Ni(CO)4的配位体为CO,O可用N-或C2-代替,所以形成的等电子体可以为:CN- 或C22-,
故答案为:分子晶体;sp3杂化;CN- 或C22- ;
(3)黄血盐[K4Fe(CN)63H2O]中,三种同周期非金属元素为C、N、O,同一周期从左到右第一电离能有增大的趋势,但N原子具有半充满稳定状态,第一电离能大于O,所以第一电离能由小到大顺序为C <O< N,
故答案为:C <O< N;
(4)含氧酸中所含非羟基氧数目越多酸性越强,H2SeO4中非羟基氧数目为2,H2SeO3中非羟基氧数目为1,故酸性H2SeO4>H2SeO3,
故答案为:H2SeO4>H2SeO3;因为H2SeO4中非羟基氧数目比H2SeO3多,使得H2SeO4中羟基氢更易电离,故H2SeO4酸性更强;
(5)根据晶胞结构分析,由于阴离子是面心立方堆积,Ni2+填充在八面体空隙,所以晶胞边长为a=2r(Ni2+)+2r(O2-)=2![]() 69nm+2×140nm=418nm,由晶胞结构可知,一个晶胞中实际拥有4个Ni2+和4个O2-,则晶体的密度
69nm+2×140nm=418nm,由晶胞结构可知,一个晶胞中实际拥有4个Ni2+和4个O2-,则晶体的密度![]() =
=![]() =
=![]() g/cm3。
g/cm3。
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是( )
A. 1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数量为0.1NA
B. 1mol Na2O2与足量的水反应,转移的电子数为2NA
C. 标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
D. 0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,遇到盐酸或强碱溶液都能反应的一组是
A.Cu Al2O3NaHCO3B.Mg Al(OH)3Na2CO3
C.Fe Al2O3Al(OH)3D.Al NaHCO3Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能说明氯元素的非金属性比硫元素强的事实是( )
A. Cl2与H2S溶液发生置换反应
B. 受热时H2S能分解,HCl则不能
C. 硫和Cl2分别与氢气化合时, Cl2比硫更容易
D. 溶于水时HCl是强酸,H2S是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
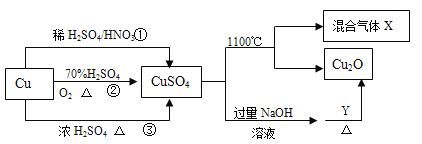
A. Y可以是葡萄糖
B. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
C. 相对于途径①、③,途径②更好地体现了绿色化学思想
D. 1 mol CuSO4在1100 ℃所得混合气体X中O2为0.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下:

查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如下图是所示。
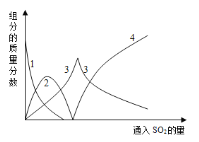
(1)如图中的线2表示的组分为____________(填化学式)
(2)写出如图曲线4的反应方程式:__________________________
(3)实验时,“反应Ⅱ”中加入NaOH溶液的目的是_______________________(用化学方程式表示)
(4)国家标准规定产品中Na2SO3的质量分数≥97.0%为优等品,≥93.0%为一等品。为了确定实验所得产品的等级,研究小组采用了下列方法进行测定。
称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过滤、洗涤、干燥后称重,质量为4.660g,通过计算确定产品中Na2SO3的质量分数(写出计算过程)。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa, 25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L-1NaOH溶液滴定20 mL0.1mol·L-1H2A溶液的滴定曲线如图所示。下列说法正确的是( )
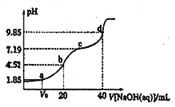
A. a点所得溶液中:c(H2A)>c(HA-) B. b点所得溶液中:c(H2A)+(H+)=c(HA-)+c(OH-)
C. c点所得溶液中:c(A2-)=c(HA-) D. d点所得溶液中A2-水解平衡常数Kh1=10-7.19
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com