
【题目】肉桂醛F (![]() )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
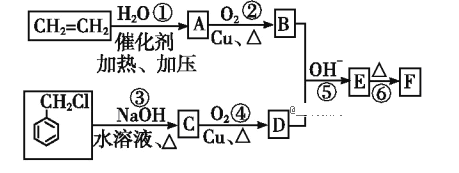
已知:两个醛分子在NaOH溶液作用下可以发生反应,生成一种羟基醛:
![]() +
+ ![]()
![]()
![]()
请回答:
(1)D的名称为__________________。
(2)反应①~⑥中属于加成反应的是___________(填序号)。
(3)写出反应③的化学方程式:______________________________________;
反应④的化学方程式:_________________________________________。
(4)在实验室里鉴定![]() 分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是__________(请按实验步骤操作的先后次序填写序号)。
分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是__________(请按实验步骤操作的先后次序填写序号)。
A.滴加AgNO3溶液 B.加NaOH溶液 C.加热 D.用稀硝酸酸化
(5)E的同分异构体有多种,其中之一甲属于酯类。甲可由H(已知H的相对分子量为32)和芳香酸G制得,则甲的结构共有__________种。
(6)根据已有知识并结合相关信息日,写出以乙烯为原料制备CH3CH=CHCHO的合成路线流程图(无机试剂任选)。合成路线流程图例如下:_____________________
![]()
【答案】苯甲醛①⑤![]() +NaOH
+NaOH![]()
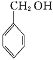 +NaCl 2
+NaCl 2 +O2
+O2 ![]() 2
2![]() + 2H2OBCDA4
+ 2H2OBCDA4![]()
【解析】
CH2=CH2与水反应生成A,A为乙醇;乙醇催化氧化得到B,B为乙醛;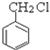 与氢氧化钠水溶液反应生成C,C为
与氢氧化钠水溶液反应生成C,C为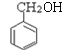 ;
; 催化氧化得到D,D为
催化氧化得到D,D为![]() ;乙醛和
;乙醛和![]() 反应生成E,E为
反应生成E,E为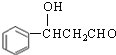 ;
;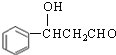 发生消去反应得到F,F为
发生消去反应得到F,F为![]() .再结合对应有机物的结构和性质,据此分析可得结论。
.再结合对应有机物的结构和性质,据此分析可得结论。
(1) 与氢氧化钠水溶液反应生成C,C为
与氢氧化钠水溶液反应生成C,C为 ;
; 催化氧化得到D,D为
催化氧化得到D,D为![]() ,故答案为:苯甲醛;
,故答案为:苯甲醛;
(2)由上述流程分析可知反应①、⑤为加成反应,故答案为:①、⑤;
(3) 与氢氧化钠水溶液反应生成C,C为
与氢氧化钠水溶液反应生成C,C为 ,方程式为:
,方程式为: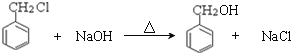 ;
; 催化氧化生成
催化氧化生成![]() ,故答案为:
,故答案为: ;2
;2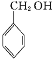 +O2
+O2 ![]() 2
2![]() + 2H2O;
+ 2H2O;
(4)检验卤代烃中的卤素时,应先在碱性条件下加热水解,然后用硝酸酸化后再加入硝酸银溶液,故答案为:BCDA;
(5)由题意可得H为甲醇,芳香酸G可以是苯乙酸、甲基苯甲酸、间甲基苯甲酸、对甲基苯甲酸四种,则甲也有四种结构,故答案为:4;
(6)以乙烯为原料制备CH3CH=CHCHO,通为原料与目标产物的对比,发现可通过两个醛加成,然后再消去来实现制备,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】【化学选修-物质结构与性质】
已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大,B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同.请回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序是______(填元素符号)
(2)化合物BD3的分子空间构型可描述为______,B的原子轨道杂化类型为______。
(3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输.已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物.则F的基态原子价电子排布式为______。CN-与______(一种分子)互为等电子体,则1个CN-中π键数目为______。
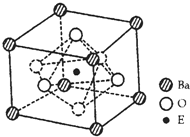
(4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为______,
在该晶体中,E4+的氧配为数为______。若该晶胞边长为anm可计算该晶体的密度为______g/cm3(阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是( )
A. 1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数量为0.1NA
B. 1mol Na2O2与足量的水反应,转移的电子数为2NA
C. 标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
D. 0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中表达正确的是( )
A. 第VⅡA族元素形成的氢化物中沸点最高的是HI
B. 水分子很稳定性是因为水分子间易形成氢键
C. 用电子式表示HCl形成过程:![]()
D. 第三周期元素形成的简单离子中,半径最小的是Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2。A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱如图。关于A的下列说法中,不正确的是
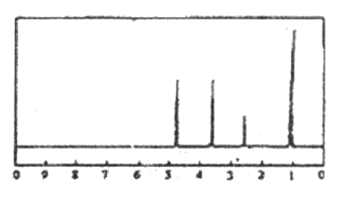
A. A分子属于酯类化合物
B. A在一定条件下可与H2发生加成反应
C. 符合题中A分子结构特征的有机物不只有一种
D. 与A属于同类化合物的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁(FeSO4·XH2O),在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________;写出相关化学离子方程式:_____________、______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
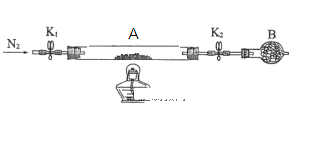
①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
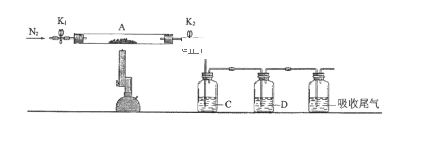
C、D中的溶液依次为BaCl2溶液、浓H2SO4。C、D中有气泡冒出,并可观察到的现象分别为产生白色沉淀、品红溶液褪色。写出硫酸亚铁高温分解反应的化学方程式:_________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,遇到盐酸或强碱溶液都能反应的一组是
A.Cu Al2O3NaHCO3B.Mg Al(OH)3Na2CO3
C.Fe Al2O3Al(OH)3D.Al NaHCO3Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下:

查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如下图是所示。
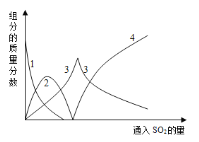
(1)如图中的线2表示的组分为____________(填化学式)
(2)写出如图曲线4的反应方程式:__________________________
(3)实验时,“反应Ⅱ”中加入NaOH溶液的目的是_______________________(用化学方程式表示)
(4)国家标准规定产品中Na2SO3的质量分数≥97.0%为优等品,≥93.0%为一等品。为了确定实验所得产品的等级,研究小组采用了下列方法进行测定。
称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过滤、洗涤、干燥后称重,质量为4.660g,通过计算确定产品中Na2SO3的质量分数(写出计算过程)。_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com