
【题目】下列事实不能用化学平衡移动原理解释的是( )
A.向AgCl浊液中加入少量KI溶液,可看到白色沉淀变为黄色沉淀
B.高压比常压更有利于N2和H2转化为NH3
C.蒸干AlCl3溶液无法得到无水AlCl3
D.滴加少量CuSO4溶液可以加快Zn与稀H2SO4反应的速率
【答案】D
【解析】
勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动;使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用。
A.AgCl的浊液中加入KI溶液,AgI更难溶,实现了沉淀的转化:AgCl+I- ![]() AgI+Cl-,可以用勒夏特列原理解释,故A不选;
AgI+Cl-,可以用勒夏特列原理解释,故A不选;
B.合成氨反应是气体体积减小的反应,增大压强平衡向正向移动,提高原料的利用率,可用勒夏特列原理解释,故B不选;
C.AlCl3溶液在加热时水解生成Al(OH)3和HCl,HCl易挥发,加热促进水解得到氢氧化铝,无法得到无水AlCl3,能用平衡移动原理解释,故C不选;
D.滴加少量CuSO4溶液,置换出的Cu与Zn形成原电池,加快了Zn与稀H2SO4反应的速率,与化学平衡无关,不能用勒夏特列原理解释,故D选;
故选D。


科目:高中化学 来源: 题型:
【题目】在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NO3-、I-、AlO2-
C.FeCl3溶液:K+、Na+、Fe2+、S2-
D.![]() =0.1 molL-1的溶液:Na+、K+、SiO32-、NO3-
=0.1 molL-1的溶液:Na+、K+、SiO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解;②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2。

①仪器m的名称为__,装置F中的试剂作用是__。
②装置连接顺序:__→__→__→__→__→D。__
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是__。
④为了提高S2Cl2的纯度,实验的关键是__。(写两点)
(2)S2Cl2有剧毒,少量S2Cl2泄漏时应喷水雾减慢其挥发(或扩散)。S2Cl2遇水会生成SO2、HCl两种气体,写出该反应的化学方程式__。
(3)某同学设计了如下实验方案来测定S2Cl2与水反应后的混合气体中SO2的体积分数。
![]()
①W溶液可以是__(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为__(用含V、m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中 A、F 为氨气和氯气的发生装置,C 为纯净、干燥的氯气与氨气反应的装置。
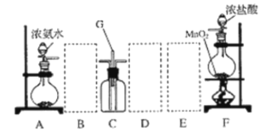
请回答下列问题:
(1)装置 F 中发生反应的离子方程式是______________。
(2)装置 A 中的烧瓶内固体可选用_______________(选填以下选项的代号)。
A 碱石灰 B 浓硫酸 C 生石灰 D 五氧化二磷 E 烧碱
(3)虚线框内应添加必要的除杂装置,请从图的备选装置中选择,并将编号填入下列空格:
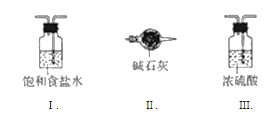
B___D____E_____
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为: ________;装置 C 内出现浓厚的白烟,该物质化学式为_________。
(5)若从装置 C 中 G 处逸出的尾气中含有 N2 和少量 C12,应如何处理________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用下图所示装置对原电池和电解原理进行实验探究.
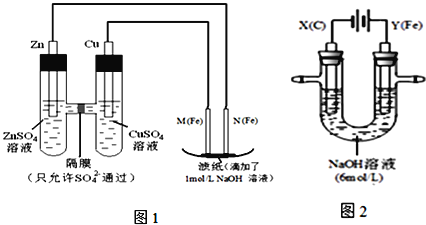
请回答:
I.用图1所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是______(填字母序号).
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为_____________.
(3)实验过程中,SO42-______(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有______________.
II.用图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(4)电解过程中,X极区溶液的pH______(填“增大”、“减小”或“不变”).
(5)电解过程中,Y极发生的电极反应为_____________和4OH-- 4e-= 2H2O + O2↑
(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少______g.
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 该电池正极发生的反应的电极反应式为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,若通入直流电![]() 时,铜电极质量增加
时,铜电极质量增加![]() 。试回答:
。试回答:

![]() 电极的反应式____________
电极的反应式____________
![]() 中电解质的浓度_____
中电解质的浓度_____![]() 填“增大”“减小”“不变”
填“增大”“减小”“不变”![]() 。
。
![]() 通电
通电![]() 时,B中共收集
时,B中共收集![]() 气体
气体![]() 标况
标况![]() ,溶液体积为
,溶液体积为![]() ,则通电前
,则通电前![]() 溶液的物质的量浓度为_______________
溶液的物质的量浓度为_______________![]() 设电解前后溶液体积无变化
设电解前后溶液体积无变化![]() 。
。
![]() 若A中KCl溶液的体积也是
若A中KCl溶液的体积也是![]() ,电解后,溶液的pH为_______
,电解后,溶液的pH为_______![]() 设电解前后溶液体积无变化
设电解前后溶液体积无变化![]() 。A中电解的总离子方程式是_________
。A中电解的总离子方程式是_________
![]() 若电源改为二甲醚碱性燃料电池,则X极的反应__________
若电源改为二甲醚碱性燃料电池,则X极的反应__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 所有铵盐受热均可以分解,产物均有NH3
B. 所有铵盐都易溶于水,所有铵盐中的N均呈-3价
C. NH4Cl溶液中加入NaOH浓溶液共热时反应的离子方程式为NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. NH4Cl和NaCl的固体混合物可用升华法分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列关于有机实验的问题。
(1)甲同学进行淀粉水解实验,为了检验淀粉水解的产物,设计如下实验方案:
![]()
①试剂1为20%的H2SO4溶液,其作用是__________________________。
②有同学忘记加试剂2,在实验最后没有看到砖红色的现象,原因是__________________。
③若要检验淀粉是否完全水解,在_______(填图中框内物质)中加入_______(填试剂名称)试剂。
(2)乙同学进行苯的硝化反应。实验流程如图顺序。已知:硝基苯沸点为210℃,蒸馏分离时选用空气冷凝管。
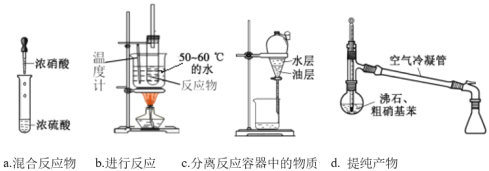
①写出苯的硝化反应的方程式:_______。
②d的蒸馏操作中加入沸石的作用是_______。
③上述操作或者装置中有错误的是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com