
【题目】在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NO3-、I-、AlO2-
C.FeCl3溶液:K+、Na+、Fe2+、S2-
D.![]() =0.1 molL-1的溶液:Na+、K+、SiO32-、NO3-
=0.1 molL-1的溶液:Na+、K+、SiO32-、NO3-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对于密闭容器中的反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,450℃时,n(SO3)和n(O2)随时间的变化关系如图所示,下列说法正确的是
2SO3(g) △H<0,450℃时,n(SO3)和n(O2)随时间的变化关系如图所示,下列说法正确的是

A.点c处反应达到平衡
B.点a的正反应速率比点b的大
C.点d (t1时刻)和点e (t2时刻)处n(SO2)不一样
D.其他条件不变,600℃时反应至t1时刻,n(SO 3)比上图中的e点值要大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在当今社会,氮的氢化物和氧化物与我们的生活息息相关.
(1)NO是一种污染物,工业上用NH3、O2脱除烟气中NO的原理如图所示,该原理中NO最终转化为______(填化学式),V4+﹣O﹣H在反应过程中作___________。当消耗2molNH3和0.5molO2时,除去的NO在标准状况下的体积为____________L。

(2)N2H4是发射航天火箭的常用燃料,已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=﹣538kJ·mol﹣1。断开1mol下列化学键系数的能量分别为N﹣H:390kJ、N≡N:946kJ、O﹣H:460kJ、O=O:498kJ。则断开1molN﹣N需要吸收的能量是__________.
(3)工业制硝酸时,会发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0。
4NO(g)+6H2O(g) △H<0。
①若其它条件不变,则下列图象不正确的是_____(填字母)。
A. B.
B.  C.
C. D.
D.
②在1L容积固定的密闭容器中充入NH3和O2发生该反应,部分物质的浓度随时间的变化如下表所示。
| c(NH3)/mol·L﹣1 | c(O2)/mol·L﹣1 | c(NO)mol·L﹣1 |
0 | 1.2 | 1.75 | 0 |
4min | 0.4 | 0.75 | 0.8 |
6min | 0.4 | 0.75 | 0.8 |
8min | 0.6 | 1 | 0.6 |
9min | 0.6 | 1 | 0.6 |
10min | 1.05 | 1 | 1.05 |
12min | … | … | … |
0~4min内,用O2表示该反应的平均反应速率为______mol·L﹣1·min﹣1。反应6~8min时改变了反应条件,改变的反应条件可能是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母)。
a.碳棒b.锌板c.铜板

(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的________(填“正”或“负”)极。F电极上的电极反应式为____________________________________________________________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_________________________________________________________________________。

(3)乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图3所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为_______________________________________________________。
②若有2mol H+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水(过氧化氢的水溶液)在工业生产和日常生活中应用广泛。
(1)双氧水常用于伤口消毒,这一过程利用了过氧化氢的_________(填过氧化氢的化学性质)。
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。已知0.4 mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,并放出256.652kJ的热量。该反应的热化学方程式为__________。
(3)双氧水能将碱性废水中的CN-转化成碳酸盐和一种对环境无污染的气体,CN-的电子式为________,写出该反应的离子方程式________。
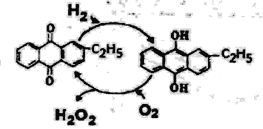
(4)下图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式_______。
(5)下图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。
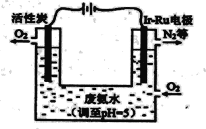
①Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式是_______。
②处理废氨水中溶质(以NH3计)的质量是34g,理论上电路中转移电子数为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成问题
![]() 通过如图所示电解装置可将
通过如图所示电解装置可将![]() 转化为硫酸,电极材料皆为石墨。则A为电解池的_________
转化为硫酸,电极材料皆为石墨。则A为电解池的_________![]() 填“阴极”或“阳极”
填“阴极”或“阳极”![]() 。C为________
。C为________![]() 填物质名称
填物质名称![]() 。若将阴离子交换膜换成阳离子交换膜,写出阳极区域发生的电极反应:_______。
。若将阴离子交换膜换成阳离子交换膜,写出阳极区域发生的电极反应:_______。

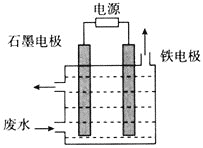
![]() 用如图所示装置处理含
用如图所示装置处理含![]() 废水时,控制溶液pH为
废水时,控制溶液pH为![]() 并加入NaCl,一定条件下电解,阳极产生的
并加入NaCl,一定条件下电解,阳极产生的![]() 将
将![]() 氧化为无害物质而除去。铁电极为_________
氧化为无害物质而除去。铁电极为_________![]() 填“阴极”或“阳极”
填“阴极”或“阳极”![]() ,阳极产生
,阳极产生![]() 的电极反应为_______,阳极产生的
的电极反应为_______,阳极产生的![]() 将
将![]() 氧化为无害物质而除去的离子方程式为______。
氧化为无害物质而除去的离子方程式为______。
![]() 以连二亚硫酸根离子
以连二亚硫酸根离子![]() 为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

阴极区的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W、X、Y、Z原子的最外层电子数之和为21,下列说法中不正确的是

A. 原子半径:X>Y>W
B. 简单阴离子的还原性:Z>W
C. 气态氢化物的稳定性:W>Y
D. 氧化物对应水化物的酸性:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是( )
A.向AgCl浊液中加入少量KI溶液,可看到白色沉淀变为黄色沉淀
B.高压比常压更有利于N2和H2转化为NH3
C.蒸干AlCl3溶液无法得到无水AlCl3
D.滴加少量CuSO4溶液可以加快Zn与稀H2SO4反应的速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com