
【题目】某课外小组分别用下图所示装置对原电池和电解原理进行实验探究.
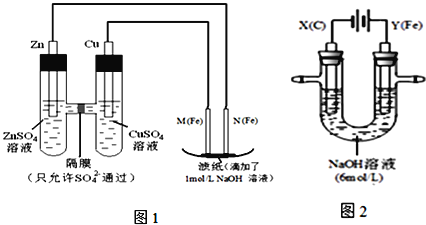
请回答:
I.用图1所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是______(填字母序号).
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为_____________.
(3)实验过程中,SO42-______(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有______________.
II.用图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(4)电解过程中,X极区溶液的pH______(填“增大”、“减小”或“不变”).
(5)电解过程中,Y极发生的电极反应为_____________和4OH-- 4e-= 2H2O + O2↑
(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少______g.
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 该电池正极发生的反应的电极反应式为__________.
【答案】 A 2H++ 2e-= H2↑(或2H2O + 2e-= H2↑+ 2OH-) 从右向左 滤纸上有红褐色斑点产生(答出“红褐色斑点”或“红褐色沉淀”即可给分) 增大 Fe-6e-+8OH-═FeO42-+4H2O 0.28 2FeO42- + 6e- + 5H2O = Fe2O3 + 10OH-
【解析】(1)在保证电极反应不变的情况下,仍然是锌作负极,则正极材料必须是不如锌活泼的金属或导电的非金属,铝是比锌活泼的金属,所以不能代替铜,故选A;
(2)N电极连接原电池负极,所以是电解池阴极,阴极上氢离子得电子发生还原反应,电极反应式为:2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-),故答案为:2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-);
(3)原电池放电时,阴离子向负极移动,所以硫酸根从右向左移动,电解池中,阴极上氢离子得电子生成氢气,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化生成氢氧化铁,所以滤纸上有红褐色斑点产生,故答案为:从右向左;滤纸上有红褐色斑点产生;
(4)电解过程中,阴极上氢离子放电生成氢气,则阴极附近氢氧根离子浓度大于氢离子溶液,溶液呈碱性,溶液的pH增大,故答案为:增大;
(5)铁是活泼金属,电解池工作时,阳极上铁失电子发生氧化反应,氢氧根离子失电子发生氧化反应,所以发生的电极反应式为:Fe-6e-+8OH-═FeO42-+4H2O和4OH--4e-═2H2O+O2↑,故答案为:Fe-6e-+8OH-═FeO42-+4H2O;
(6)X电极上析出的是氢气,Y电极上析出的是氧气,且Y电极失电子进入溶液,设铁质量减少为xg,根据转移电子数相等得![]() ×2=
×2=![]() ×4+
×4+![]() ×6,解得:x=0.28,故答案为:0.28;
×6,解得:x=0.28,故答案为:0.28;
(7)正极上高铁酸根离子得电子发生还原反应,反应方程式为2FeO42-+6e-+5H2O═Fe2O3+10OH-,故答案为:2FeO42-+6e-+5H2O═Fe2O3+10OH-。


科目:高中化学 来源: 题型:
【题目】双氧水(过氧化氢的水溶液)在工业生产和日常生活中应用广泛。
(1)双氧水常用于伤口消毒,这一过程利用了过氧化氢的_________(填过氧化氢的化学性质)。
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。已知0.4 mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,并放出256.652kJ的热量。该反应的热化学方程式为__________。
(3)双氧水能将碱性废水中的CN-转化成碳酸盐和一种对环境无污染的气体,CN-的电子式为________,写出该反应的离子方程式________。
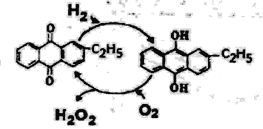
(4)下图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式_______。
(5)下图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。
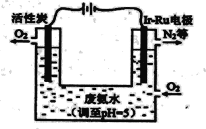
①Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式是_______。
②处理废氨水中溶质(以NH3计)的质量是34g,理论上电路中转移电子数为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是重要的资源,可以制备一系列物质。下列说法不正确的是( )

A.要除去粗盐中![]() 、
、![]() 、
、![]() 等杂质,步骤
等杂质,步骤![]() 中所加试剂及相关操作顺序可以是过量NaOH溶液
中所加试剂及相关操作顺序可以是过量NaOH溶液![]() 过量
过量![]() 溶液
溶液![]() 过量
过量![]() 溶液
溶液![]() 过滤
过滤![]() 盐酸
盐酸
B.步骤![]() 的反应原理为
的反应原理为![]()
![]()
![]()
C.步骤![]() 中需将
中需将![]() 置于干燥的HCl气流中加热脱水制备无水
置于干燥的HCl气流中加热脱水制备无水![]()
D.步骤![]() 、
、![]() 、
、![]() 所涉及的反应中,溴元素均发生氧化反应
所涉及的反应中,溴元素均发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应I2(g) + H2(g)![]() 2HI(g) ΔH =-14.9 kJ·mol-1,能说明反应已经达到化学平衡状态的是
2HI(g) ΔH =-14.9 kJ·mol-1,能说明反应已经达到化学平衡状态的是
A.各物质的浓度相等
B.反应容器内压强不变
C.容器内颜色不再变化
D.单位时间内断裂a mol H-H键,同时形成2a mol H-I键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是( )
A.向AgCl浊液中加入少量KI溶液,可看到白色沉淀变为黄色沉淀
B.高压比常压更有利于N2和H2转化为NH3
C.蒸干AlCl3溶液无法得到无水AlCl3
D.滴加少量CuSO4溶液可以加快Zn与稀H2SO4反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲池是乙醇燃料电池,电解乙池硝酸银溶液。M、N两个电极均为石墨电极,请回答下列问题:
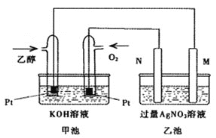
![]() 甲池中乙醇电极名称是______,
甲池中乙醇电极名称是______,![]() 填正极或负极
填正极或负极![]() ,通
,通![]() 的铂电极反应式为_______。一段时间后,该池pH_______
的铂电极反应式为_______。一段时间后,该池pH_______![]() 填增大、减小、不变
填增大、减小、不变![]() 。
。
![]() 乙池中溶液中
乙池中溶液中![]() 的向______极
的向______极![]() 填M或
填M或![]() 移动,在此过程中,乙池中某极析出金属
移动,在此过程中,乙池中某极析出金属![]() 时,甲池中理论上消耗氧气为______
时,甲池中理论上消耗氧气为______![]() 标准状况下
标准状况下![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及解释或结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 解释或结论 |
A | 向足量的浓硝酸中加入铁片,一段时间后加入铜粉 | 有气体生成,溶液呈蓝绿色 | 浓硝酸将Fe氧化为 |
B | 分别向 | 均有白色沉淀产生 | 金属性: |
C | 表面变黑的银器浸泡到盛有食盐水的铝制容器中,银器与铝接触 | 银器变得光亮如新 | 构成原电池,铝做负极,硫化银得电子被还原成单质银 |
D | 向 | 白色沉淀逐渐变为浅蓝色 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是 ( )
A.煤、石油、天然气属于不可再生能源
B.地球上最基本的能源是太阳能,大自然利用太阳能最成功的是植物的光合作用
C.![]() 是理想的清洁燃料,储存和运输方便,在现实生活和生产中已大量应用
是理想的清洁燃料,储存和运输方便,在现实生活和生产中已大量应用
D.通过煤的气化、液化等方法将煤转化为CO、![]() 等燃料,可以提高煤燃烧的热效率
等燃料,可以提高煤燃烧的热效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.在含有![]() 沉淀的溶液中加入
沉淀的溶液中加入![]() 固体,
固体,![]() 增大
增大
C.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
D.物质的溶解度随温度的升高而增加,物质的溶解都是吸热的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com