
【题目】下列叙述不正确的是 ( )
A.煤、石油、天然气属于不可再生能源
B.地球上最基本的能源是太阳能,大自然利用太阳能最成功的是植物的光合作用
C.![]() 是理想的清洁燃料,储存和运输方便,在现实生活和生产中已大量应用
是理想的清洁燃料,储存和运输方便,在现实生活和生产中已大量应用
D.通过煤的气化、液化等方法将煤转化为CO、![]() 等燃料,可以提高煤燃烧的热效率
等燃料,可以提高煤燃烧的热效率
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)__________________________。
(2)上述B步骤操作的目的是__________________________________________。
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果______(填“偏高“、“偏低”或“不变”)
(4)判断到达滴定终点的实验现象是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用下图所示装置对原电池和电解原理进行实验探究.
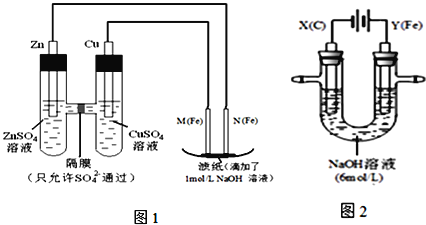
请回答:
I.用图1所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是______(填字母序号).
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为_____________.
(3)实验过程中,SO42-______(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有______________.
II.用图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(4)电解过程中,X极区溶液的pH______(填“增大”、“减小”或“不变”).
(5)电解过程中,Y极发生的电极反应为_____________和4OH-- 4e-= 2H2O + O2↑
(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少______g.
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 该电池正极发生的反应的电极反应式为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl4是制备钛及其化合物的重要中间体,可利用下列装置在实验室制备TiCl4(夹持装置略去): TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
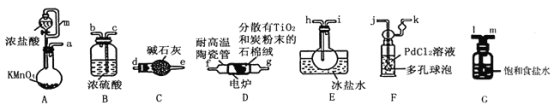
已知:①PdCl2溶液捕获CO时生成Pd单质;②相关数据如下表:
化合物 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 溶解性 |
TiCl4 | -25 | 136 | 1.5 | 能溶于有机溶剂:遇水分解生成难溶于水的物质 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
回答下列问题:
(1)装置A中连通管的作用是______;装置E中使用冰盐水浴的目的是_____________________。
(2)按照气流由左到右的方向,上述装置合理的连接顺序为____________________ (填仪器接口字母);根据完整的实验装置进行实验,实验步骤如下:_____________; 装入药品;向装置A烧瓶中滴加适量浓盐酸,当观察到_________时,加热装置D中陶瓷管;装置E烧瓶中的液体量不再增加时,停止加热,充分冷却。
(3)装置C的作用为___________________。
(4)装置F中发生反应的化学方程式为________________________。
(5)制得的TiCl4中常含有少量CCl4, 从混合液体中分离出TiCl4的操作名称为_______________。
(6)利用如图所示装置测定产品纯度:称取w g TiCl4产品进行实验,向安全漏斗中加入适量蒸馏水,待四氯化钛充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,用氢氧化钠溶液调节至中性,滴加几滴0.1 molL-1的K2CrO4溶液作指示剂,用cmol L-1 AgNO3标准溶液滴定至终点( Ag2CrO4为红棕色沉淀,可指示滴定终点),重复滴定两次,平均消耗标准溶液V mL。
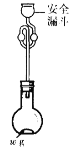
已知:TiCl4 +(2+x)H2O=TiO2xH2O↓+4HCl
①安全漏斗在本实验中的作用除加水外,还有___________。
②根据上述数据计算该产品的纯度为__________。(用含w、c和V的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 所有铵盐受热均可以分解,产物均有NH3
B. 所有铵盐都易溶于水,所有铵盐中的N均呈-3价
C. NH4Cl溶液中加入NaOH浓溶液共热时反应的离子方程式为NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. NH4Cl和NaCl的固体混合物可用升华法分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离
B.电解质越弱,则其溶液的导电能力就越差
C.在白色ZnS沉淀上滴![]() 溶液,沉淀变黑,说明相同条件下溶解度CuS比ZnS更小
溶液,沉淀变黑,说明相同条件下溶解度CuS比ZnS更小
D.加热NaR溶液时,溶液的pH变小,证明HR为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐
B.已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.01%
C.0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液等体积混合,则溶液中: 2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-)
D.在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业生产上中,主要用Na2SO3制造亚硫酸纤维素酯、硫代硫酸钠、有机化学药品、漂白织物等。但Na2SO3在空气中易氧化为Na2SO4而变质。为了求出变质样品中Na2SO3的含量,采用0.2 mol·L-1KMnO4酸性溶液滴定用样品配制的溶液。反应离子方程式是:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O,称取20 g样品,配成250 mL溶液,量取25 mL进行滴定,记录数据,再重复2次实验。
填空完成问题:
(1)滴定实验不需要下列仪器中的________。
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL) C.量筒(10 mL) D.锥形瓶 E.铁架台 F.滴定管夹
G.白纸 H.玻璃棒
(2)已知滴定过程不需要指示剂,理由是_______________________。
(3)下列操作中可能使所测Na2SO3溶液的浓度数值偏低的是________(填字母)。
A.盛放Na2SO3溶液的滴定管没有使用Na2SO3溶液润洗
B.锥形瓶内有水残留,没有烘干,装入待测的Na2SO3溶液滴定
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
(4)滴定完毕,三次实验平均消耗0.2 mol·L-1KMnO4酸性溶液20.00mL,则样品中Na2SO3的百分含量为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着工业的迅速发展,废水的种类和数量迅猛增加,对水体的污染也日趋广泛和严重,威胁人类的健康和安全.因此工业废水的处理是当代一个重要的课题.

![]() 臭氧是一种强氧化剂,在处理含氰
臭氧是一种强氧化剂,在处理含氰![]() 废水过程中由于无二次污染,而备受关注.该过程由两步反应组成:
废水过程中由于无二次污染,而备受关注.该过程由两步反应组成:![]()
总反应的化学方程式为 ______ ,该反应![]() ______ .
______ .
![]() 工业含磷废水中含大量的
工业含磷废水中含大量的![]() ,可通过投放镁盐进行除磷.
,可通过投放镁盐进行除磷.
![]() 投放的镁盐让磷酸根形成
投放的镁盐让磷酸根形成![]() 沉淀而除磷.如图1显示,沉淀过程的 pH 对废水中磷的去除率影响很大.从如图可知,最佳除磷的pH范围是 ______
沉淀而除磷.如图1显示,沉淀过程的 pH 对废水中磷的去除率影响很大.从如图可知,最佳除磷的pH范围是 ______ ![]() 当pH较高时,磷去除率下降的原因是 ______ .
当pH较高时,磷去除率下降的原因是 ______ .
![]() 若处理后的废水中
若处理后的废水中![]() 时,试计算溶液中的
时,试计算溶液中的![]() 写出计算过程,已知
写出计算过程,已知![]()
![]() 若废水中还含有大量的
若废水中还含有大量的![]() ,投放镁盐,可得到磷酸氨镁晶体
,投放镁盐,可得到磷酸氨镁晶体![]() ,可用作化肥.写出该反应的离子方程式 ______ .
,可用作化肥.写出该反应的离子方程式 ______ .
![]() 实验表明,其他条件相同时学科王,温度越高,残余磷浓度越高.已知
实验表明,其他条件相同时学科王,温度越高,残余磷浓度越高.已知![]() 时,
时,![]() 反应时间t的变化曲线如图
反应时间t的变化曲线如图![]() 若保持其他条件不变,请在坐标图中,画出
若保持其他条件不变,请在坐标图中,画出![]() 时
时![]() 反应时间t的变化曲线示意图。
反应时间t的变化曲线示意图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com