
【题目】在工业生产上中,主要用Na2SO3制造亚硫酸纤维素酯、硫代硫酸钠、有机化学药品、漂白织物等。但Na2SO3在空气中易氧化为Na2SO4而变质。为了求出变质样品中Na2SO3的含量,采用0.2 mol·L-1KMnO4酸性溶液滴定用样品配制的溶液。反应离子方程式是:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O,称取20 g样品,配成250 mL溶液,量取25 mL进行滴定,记录数据,再重复2次实验。
填空完成问题:
(1)滴定实验不需要下列仪器中的________。
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL) C.量筒(10 mL) D.锥形瓶 E.铁架台 F.滴定管夹
G.白纸 H.玻璃棒
(2)已知滴定过程不需要指示剂,理由是_______________________。
(3)下列操作中可能使所测Na2SO3溶液的浓度数值偏低的是________(填字母)。
A.盛放Na2SO3溶液的滴定管没有使用Na2SO3溶液润洗
B.锥形瓶内有水残留,没有烘干,装入待测的Na2SO3溶液滴定
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
(4)滴定完毕,三次实验平均消耗0.2 mol·L-1KMnO4酸性溶液20.00mL,则样品中Na2SO3的百分含量为:_________。
【答案】CH 因为KMnO4被还原剂还原成Mn2+,紫红色褪去,所以不需要指示剂 AD 63%
【解析】
(1)根据滴定原理,结合物质的性质选择合适的仪器;
①酸性高锰酸钾具有强氧化性,实验时应用酸式滴定管,滴定过程还需要锥形瓶和滴定管夹;
根据酸性高锰酸钾溶液为紫红色,过程中不需要加指示剂;
(2)根据KMnO4反应前后的颜色变化分析;
(3)根据c=![]() 分析判断滴定误差;
分析判断滴定误差;
(4)根据二者反应的物质的量关系计算样品中Na2SO3的物质的量,再计算其质量,进而可得Na2SO3的百分含量。
(1)用KMnO4溶液滴定变质样品中Na2SO3的含量,由于酸性高锰酸钾具有强氧化性,实验时应用酸式滴定管,将一定体积的Na2SO3通过碱式滴定管放入到锥形瓶中,滴定管放在铁架台的滴定管夹上,为了便于观察指示剂的颜色变化来确定滴定终点,要在锥形瓶下面垫上一张白纸,所以不使用的仪器有量筒(10 mL)和玻璃棒,故合理选项是CH;
(2)用KMnO4溶液滴定Na2SO3,反应后KMnO4被还原产生Mn2+,溶液变为无色,所以不需要指示剂;
(3)A.盛放Na2SO3溶液的滴定管没有使用Na2SO3溶液润洗,则消耗标准KMnO4溶液体积偏小,Na2SO3溶液物质的量偏少,根据c=![]() 可知Na2SO3的浓度偏低,A符合题意;
可知Na2SO3的浓度偏低,A符合题意;
B.锥形瓶内有水残留,没有烘干,装入待测的Na2SO3溶液滴定,不影响溶质的物质的量和溶液的体积,因此对Na2SO3的浓度无影响,B不符合题意;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,V(标准)偏大,导致Na2SO3的浓度偏高,C不符合题意;
D.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数,则V(标准)偏小,导致Na2SO3的浓度偏低,D符合题意;
故合理选项是AD;
(4)25mL溶液消耗高锰酸钾的物质的量n(KMnO4)=cV=0.2 mol/L×0.02L=0.004mol,根据反应关系2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O可知n(SO32-)=![]() n(KMnO4)=
n(KMnO4)=![]() ×0.004mol=0.01mol,m(Na2SO3)= 0.01mol×126g/mol=1.26g,则样品中Na2SO3的百分含量为[(1.26g×
×0.004mol=0.01mol,m(Na2SO3)= 0.01mol×126g/mol=1.26g,则样品中Na2SO3的百分含量为[(1.26g×![]() )÷20 g]×100%=63%。
)÷20 g]×100%=63%。


科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应I2(g) + H2(g)![]() 2HI(g) ΔH =-14.9 kJ·mol-1,能说明反应已经达到化学平衡状态的是
2HI(g) ΔH =-14.9 kJ·mol-1,能说明反应已经达到化学平衡状态的是
A.各物质的浓度相等
B.反应容器内压强不变
C.容器内颜色不再变化
D.单位时间内断裂a mol H-H键,同时形成2a mol H-I键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是 ( )
A.煤、石油、天然气属于不可再生能源
B.地球上最基本的能源是太阳能,大自然利用太阳能最成功的是植物的光合作用
C.![]() 是理想的清洁燃料,储存和运输方便,在现实生活和生产中已大量应用
是理想的清洁燃料,储存和运输方便,在现实生活和生产中已大量应用
D.通过煤的气化、液化等方法将煤转化为CO、![]() 等燃料,可以提高煤燃烧的热效率
等燃料,可以提高煤燃烧的热效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) ![]() Ca2+(aq)+2OH-(aq)。下列说法正确的是( )
Ca2+(aq)+2OH-(aq)。下列说法正确的是( )
A.恒温下向溶液中加入CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
B. 在0.1 molL﹣1 CH3COONa溶液中:n(OH﹣)+0.1mol>n(CH3COOH)+n(H+)+n(Na+)
C. 在10mL 0.1 mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6 mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)< Ksp(AgCl)
D. 常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列有关叙述正确的是( )
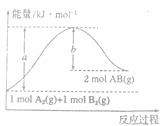
A.每生成2molAB(g)吸收bkJ热量
B.该反应中反应物的总能量高于生成物的总能量
C.反应热ΔH=+(a-b)kJ/mol
D.形成1molA-A键和1mo1B-B键,吸收akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.在含有![]() 沉淀的溶液中加入
沉淀的溶液中加入![]() 固体,
固体,![]() 增大
增大
C.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
D.物质的溶解度随温度的升高而增加,物质的溶解都是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g) + B(g) ![]() xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
A. x=1
B. B的转化率为50%
C. 2min内A的反应速率为0.3mol·L-1·min-1
D. 若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质和非电解质是对化合物的一种分类方式。下列关于电解质的说法正确的是( )
A. 液态HCl不导电,所以HCl不是电解质
B. CO2溶于水形成的溶液能导电,所以CO2是电解质
C. SO2溶于水能导电,所以SO2是电解质
D. BaSO4在水溶液中难导电,但熔融状态下能导电,所以BaSO4是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com