
����Ŀ��������100mL 1.0molL��1Na2SO4��Һ����ȷ�ķ����ǣ�������
�ٽ�7.1g Na2SO4����50mLˮ��
�ڽ�32.2g Na2SO410H2O������������ˮ�У�Ȼ������ˮϡ����100mL
�۽�25mL4.0molL��1Na2SO4��Һ����75mLˮ��
�ܽ�50mL2.0molL��1Na2SO4��Һ���뵽40mLˮ�У�Ȼ������ˮϡ����100mL��
A.�٢�
B.�٢�
C.�ڢ�
D.�ڢ�
���𰸡�D
����������7.1g Na2SO4�����ʵ���Ϊ�� ![]() =0.05mol��0.05mol����������50mLˮ�У�������Һ�������50mL������Ũ�Ȳ���1.0mol/L���ʢٲ��������⣻
=0.05mol��0.05mol����������50mLˮ�У�������Һ�������50mL������Ũ�Ȳ���1.0mol/L���ʢٲ��������⣻
��32.2g Na2SO410H2O��������ʵ���Ϊ�� ![]() =0.1mol��������Һ��Ũ��Ϊ��
=0.1mol��������Һ��Ũ��Ϊ�� ![]() =1mol/L���ʢڷ������⣻
=1mol/L���ʢڷ������⣻
��25mL4.0molL��1Na2SO4��Һ�к��������Ƶ����ʵ���Ϊ��4.0mol/L��0.025L=0.1mol��0.1mol����������75mLˮ�У�������Һ�������֪������������Ũ�ȣ��ʢ۲��������⣻
�ܽ�50mL2.0molL��1Na2SO4��Һ���뵽40mLˮ�У�Ȼ������ˮϡ����100mL��ϡ�����������Ƶ����ʵ������䣬��ϡ�ͺ������Ƶ����ʵ���Ũ��Ϊ�� ![]() =1mol/L���ʢܷ������⣻
=1mol/L���ʢܷ������⣻
���Դ��ǣ�D��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D����ѧ��ѧ�����Ļ���������ᴿ�Ļ���װ�á�
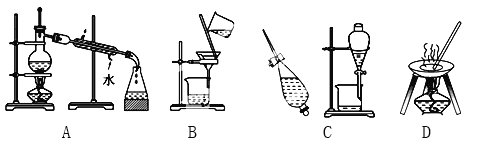
����ݻ���������ᴿ��ԭ�����ش�������ʵ������Ҫʹ����һ��װ�ã���A��B��C��D�����ʵ��Ŀո��С�
��1���ӵ�ˮ����ȡ��_____________________________��
��2��ʵ������ȡ����ˮ_____________________________��
��3��ȥ�����е���ɳ_____________________________��
��4���뺣ˮɹ��ԭ���������___________________________��
���������а������ʣ���HCl�����Cu ��CO ��CO2 �ݽ��ʯ ��KMnO4���� ��Ba(OH)2��Һ ������KAl(SO4)2
��1�����ڵ��ʵ���_________�������������������_________������״̬�ܵ���ĵ������_________��(���������ʵ����)
��2��д��Ba(OH)2��ˮ�еĵ��뷽��ʽ��____________________________________________��
��3����˫���ű�ʾ�÷�Ӧ�е���ת�Ƶķ������Ŀ_______
2KMnO4+16HCl=5Cl2��+2MnCl2+2KCl+8H2O
����0.8mol��ԭ������������ת�Ƶ��ӵ����ʵ�����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥ��������Һ�л���������Ȼ��ƣ����Բ��õķ������� ��
A. ���� B. ��Ӿ C. ����AgNO3��Һ������ D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������0.1mol/L��NaCl��Һ950mL������ʱӦѡ�õ�����ƿ�Ĺ��ͳ�ȡNaCl�������ֱ���
A.1000mL��5.85gB.950mL��5.6gC.1000mL��5.9gD.500mL��2.8g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ0.1molL��1 NaOH��Һ450mL��0.5molL��1������Һ500mL��������������Һ����������ش��������⣺
��1����ͼ��ʾ��������������Һ�϶�����Ҫ���Ǣ�������ţ�������������Һ�����õ��IJ��������Ǣ������������ƣ���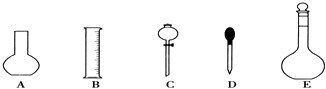
��2�����ݼ�����������ƽ��ȡNaOH������Ϊg����ʵ����������������ȷ��������ʱ���ӿ̶��ߣ���������ҺŨ��0.1molL��1������ڡ��������ڡ���С�ڡ�����
��3���ɼ���֪��������������Ϊ98%���ܶ�Ϊ1.84gcm��3��Ũ��������ΪmL������������һλС���������ʵ������15mL��20mL��50mL��Ͳ��Ӧѡ��mL��Ͳ��ã����ƹ������������ձ��н�Ũ�������ϡ�ͣ�ϡ��ʱ���������ǽ�Ũ�������ձ��ڻ�������ˮ�У����ò��������Ͻ��裮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�������ڱ��е�λ�ã���ӳ��Ԫ�ص�ԭ�ӽṹ��Ԫ�ص����ʣ���ͼ��Ԫ�����ڱ���һ���֣� 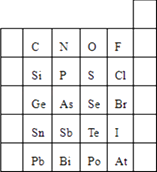
��1��Ԫ��Br��Ԫ�����ڱ��е�λ��Ϊ�������壮
��2�����ж�H3AsO4��H3PO4������ǿ��H3AsO4H3PO4 ���á�����
��������=����ʾ����
��3�����ж�HCl��H2S���ȶ���ǿ����HClH2S���á���������������=����ʾ����
д��H2��Cl2��ȼ�յĻ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ƿ����������ƿ����©������ȼ�ճף�����ƽ����Һ©�����߽�ͷ�ιܣ����������ʷ�����ǣ� ��
A.�٢ۢ�
B.�ڢܢ�
C.�٢ڢ�
D.�ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���������Ҫ�ɷ���Al2O3����������SiO2�������������ˮ����Fe2O3��MgO����ҵ�ϴ�����������ȡ���ɲ������¹������̣�
��ش��������⣺
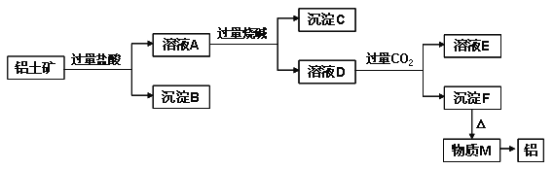
��1����ҺAת��Ϊ��ҺD���������ӷ���ʽΪ________________________________��
��2��������M��ȡ���Ļ�ѧ����ʽΪ________________________________________��
��3����ҺD��ͨ�����CO2���ɳ���F�����ӷ���ʽΪ________________________��
��4������C�ijɷ���____________ ���������������C�м����������������ȫ���ܽ⣬�˹��̵�ʵ������Ϊ_______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ĩ�п��ܺ���SiO2��Fe2O3��CuO��NaHCO3��K2CO3 �� ijͬѧ��Ʋ��������ʵ�飺�������Լ�����������֪��պȡ������Һ2�ھƾ��������գ�����ɫ�ܲ����۲�������ɫ�� ��ش�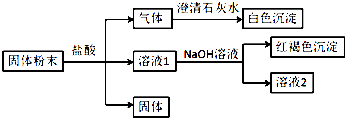
��1����ɫ���������ѧʽ����
��2�����ɺ��ɫ���������ӷ���ʽΪ ��
��3������ʵ���������ĩ��һ�����ڵ���������ѧʽ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com