
【题目】将一定量纯净的氨基甲酸铵固体置于特制的密优真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡NH2COONH4(s) ![]() 2NH3(g)+CO2(g),若保持温度和容器体积不变,再充入n (NH3): n (CO)=2:1,则再次达到平衡时c (NH3)
2NH3(g)+CO2(g),若保持温度和容器体积不变,再充入n (NH3): n (CO)=2:1,则再次达到平衡时c (NH3)
A. 增大 B. 不变 C. 变小 D. 因条件不足无法判断
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在透明溶液中能大量共存的是( )
A.K+、Cu2+、Na+、Cl-
B.H+、Na+、NO3-、HCO3-
C.Ba2+、H+、NO3-、SO42-
D.Mg2+、Na+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为Y2X3(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A. 原子半径:Y>Z>R>T B. 气态氢化物的稳定性:W<R<T
C. 最高价氧化物对应的水化物的碱性:X>Z D. XR2、WR2两种化合物中R的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )
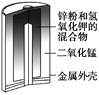
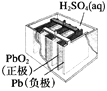
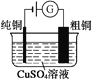
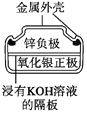
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A. 图1所示电池中,MnO2的作用是催化剂
B. 图2所示电池放电过程中,硫酸浓度不断增大
C. 图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. H2S 的电离方程式:H2S+H2O![]() H3O++HS-
H3O++HS-
B. NaHCO3在水溶液中的电离方程式:NaHCO3= Na++H++CO32-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列事实的方程式正确的是
A. 加热可增强纯碱溶液去污能力:CO32﹣+2H2O![]() H2CO3+2OH﹣
H2CO3+2OH﹣
B. 用醋酸溶液除水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
C. 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2![]() 2CO2+2CaSO4
2CO2+2CaSO4
D. 用FeS 除去工业废水中的Hg2+:Hg2++S2-=HgS↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实脸并验证①钠的物理性质;②钠和水反应的产物.请回答下列问题:

(1)实验开始时,欲使钠与水接触反应,应如何操作?________.
(2)反应开始后,试管中能观察到的实验现象是:_______(填写代号)
A.钠在水层中反应熔成小球并四处游动
B.钠在两液体界面处反应熔成小球并可能作上下跳动
C.钠在水层中反应熔成小球并四处游动
D.钠不断地减小至消失
E.钠停留在煤油层中不反应
(3)通过上述现象,能够验证钠的哪些物理性质:________
(4)100mL 容量瓶中盛有100mL0.101mol/L的BaCl2溶液,现欲将其稀释成浓度为0.100mol/L的BaCl2溶液(体积仍保持为100mL),所选用的仪器有:10mL量筒、1mL移液管(可准确移取0.10~1.00mL溶液)、胶头滴管.其简单的操作步骤是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计计如下图所示装罝(部分夹持装置己略去)进行实验探究:
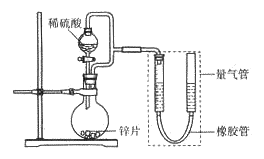
(1)用上述装置探究影响化学反应速率的因素。以生成9.0 mL气体为计时终点,结果为t1>t2。
序号 | V(H2SO4)/mL | C(H2SO4)/mol·L-1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 4 | t2 |
①比较实验I和Ⅱ可以得出的实验结论是_______________。
②若将锌片换成含杂质的粗锌片,其他条件使其与上述一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是_________(填序号)。
A.二氧化硅 B.银 C.铜 D.石墨
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用________(填序号)。
A.稀HCl B .NaCl溶液 C.乙醇 D.NaOH溶液
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在元素周期表中的位置关系如图:
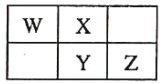
I.若Y元素原子的最外层电子数是电子层数的2倍。
(1)Z在周期表中的位置是___。
(2)写出铜和W的最高价氧化物的水化物的稀溶液反应的离子方程式:__________。
(3)Z最高价氧化物的水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28mol电子发生转移时,共产生9mol气体,写出该反应的化学方程式:____________。
II.若X和Y的核外电子数之和为22。
(4)X的气态氢化物的电子式为______,将该氢化物通入硝酸溶液中,恰好反应时所得溶液中离子浓度大小的顺序为____________。
(5)W的单质与Z的最高价氧化物的水化物的浓溶液反应,当电子转移0.4mol时,产生气体的体积是_________(标准状况)。
(6)下列能比较Z元素与氯元素非金属性强弱的是_________。
A.氯气通入硫化钠溶液中,溶液变浑浊
B.盐酸是强酸,氢硫酸是弱酸
C.氯化氢比硫化氢稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com