
【题目】在透明溶液中能大量共存的是( )
A.K+、Cu2+、Na+、Cl-
B.H+、Na+、NO3-、HCO3-
C.Ba2+、H+、NO3-、SO42-
D.Mg2+、Na+、OH-、SO42-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于甲烷、乙烯和苯的说法错误的是
A. 天然气、沼气、可燃冰的主要成分均是甲烷
B. 甲烷和乙烯互为同系物
C. 甲烷和苯都不能使酸性高锰酸钾溶液褪色
D. 乙烯能与液溴发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO的燃烧热为akJ/mol,将CO燃烧产物通入一定浓度的NaOH溶液中,所得溶液中溶质仅为Na2CO3,浓度为0.01mol/L。
(1)写出CO完全燃烧的热化学方程式__________________________;
(2)Na2CO3溶液呈碱性,可以用来去油污,用离子方程式表示Na2CO3呈碱性的原因___________________________________;
(3)写出Na2CO3溶液中的电荷守恒关系__________;(用离子浓度符号表示)
(4)计算在该浓度的Na2CO3溶液中c(CO32-)+c(HCO3-)+c(H2CO3)=____mol/L
(5)向该溶液中滴加AlCl3溶液,会有气泡和白色沉淀生成,写出发生反应的离子方程式__________________________。
(6)已知Cu(OH)2的溶度积为Ksp=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________;要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在材料制造、有机合成等方面用途非常广泛。回答下列问题:
(1)VB2是一种导电陶瓷材料,基态钒原子的价电子排布图为___________
(2)B、C、N、O四种元素第一电离能由小到大的顺序为_______________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示:
卤化物 | BF3 | BCl3 | BBr3 | BI3 |
沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是_________________。
②用BF3分子结构解释反应BF3(g)+NH4F(s)=NH4BF4(s)能够发生的原因:_________________。
③制备环硼氨烷的方法如下:
![]()
BCl3、LiBH4中硼原子的杂化轨道类型依次为_________________;与B3N3H6互为等电子体的分子的结构简式为___________________。
(4)立方氮化硼的晶胞结构与金刚石结构相似(如下图),是超硬材料。

①晶胞中每个氮原子周围与其最近且等距离的硼原子有_____个;
②结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,立方氮化硼的晶胞中, B原子的坐标参数分别有:B(0,0,0),B(![]() ,0,
,0, ![]() );B(0,
);B(0, ![]() ,
, ![]() )等,则距离上述三个B原子最近且等距离的N原子的坐标参数为___________________。
)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为___________________。
③已知氮化硼晶胞边长为apm,则氮化硼晶体的密度为____g·cm-3(设NA为阿伏加德罗常数值,只要求列算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O===Cu2O+2Ag,下列有关说法正确的是 ( )

A. 2 mol Cu与1 mol Ag2O的总能量低于1 mol Cu2O与2 mol Ag具有的总能量
B. 负极的电极反应式为2Cu+2OH--2e-===Cu2O+H2O
C. 测量原理示意图中,电流方向从Cu→Ag2O
D. 电池工作时,OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的说法正确的是
A. 向NH4Cl溶液中加入NaOH溶液至呈中性,溶液中c(Na+)=c(NH3·H2O)
B. 用少量水稀释0.1mol·L-1氨水时;溶液中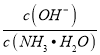 减小
减小
C. 将Na2CO3溶液从20℃升温至30℃,溶液中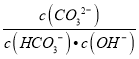 增大
增大
D. pH=5.5的CH3COOH与CH3COONa混合溶液中c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分中学化学常见元素的原子结构及性质如下表所示:
元素 | 结构及性质 |
A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
B | B原子最外层电子数是内层电子总数的1/5 |
C | C是常见化肥的主要元素,单质常温下呈气态 |
D | D是地壳中含量最丰富的金属元素,工业上可通过电解法获取其单质 |
E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
F | F在周期表中可以排在IA族,也有人提出排在VIIA族 |
(1)A元素在周期表中的位置为第_____周期_____族。
(2)B与C形成的化合物的化学式为______,它属于____(填“离子”或“共价”)化合物。
(3)F与E可以形成原子个数比分别为2:1、1:1的两种化合物X和Y。区别X与Y的水溶液的实验方法是_________________________________________。
(4)C与E都是较活泼的非金属元素,两者的非金属性强弱比较:_____>______(用化学符号回答),请例举出一个判断二者非金属性强弱的证据是____________________。
(5)有人认为B、D的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
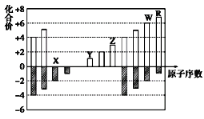
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R<W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵固体置于特制的密优真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡NH2COONH4(s) ![]() 2NH3(g)+CO2(g),若保持温度和容器体积不变,再充入n (NH3): n (CO)=2:1,则再次达到平衡时c (NH3)
2NH3(g)+CO2(g),若保持温度和容器体积不变,再充入n (NH3): n (CO)=2:1,则再次达到平衡时c (NH3)
A. 增大 B. 不变 C. 变小 D. 因条件不足无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com