
����Ŀ�����仯�����ڲ������졢�л��ϳɵȷ�����;�dz��㷺���ش��������⣺
(1)VB2��һ�ֵ����մɲ��ϣ���̬��ԭ�ӵļ۵����Ų�ͼΪ___________
(2)B��C��N��O����Ԫ�ص�һ��������С�����˳��Ϊ_______________��
(3)���±�����ڹ�ҵ������Ҫ���ã��������±����ķе����±���ʾ��
±���� | BF3 | BCl3 | BBr3 | BI3 |
�е�/K | 172 | 285 | 364 | 483 |
������±����е��������ߵ�ԭ����_________________��
����BF3���ӽṹ���ͷ�ӦBF3(g)+NH4F(s)=NH4BF4(s)�ܹ�������ԭ��_________________��
���Ʊ�������ķ������£�
![]()
BCl3��LiBH4����ԭ�ӵ��ӻ������������Ϊ_________________����B3N3H6��Ϊ�ȵ�����ķ��ӵĽṹ��ʽΪ___________________��
(4)����������ľ����ṹ����ʯ�ṹ����(����ͼ)���dz�Ӳ���ϡ�

�پ�����ÿ����ԭ����Χ��������ҵȾ������ԭ����_____����
�ڽṹ��ѧ�ϳ���ԭ�����������ʾ�����ڲ���ԭ�ӵ����λ�ã�����������ľ����У� Bԭ�ӵ���������ֱ��У�B(0��0��0)��B(![]() ��0��
��0�� ![]() )��B(0��
)��B(0�� ![]() ��
�� ![]() )�ȣ��������������Bԭ������ҵȾ����Nԭ�ӵ��������Ϊ___________________��
)�ȣ��������������Bԭ������ҵȾ����Nԭ�ӵ��������Ϊ___________________��
����֪�������߳�Ϊapm����������ܶ�Ϊ____g��cm-3(��NAΪ�����ӵ�����ֵ��ֻҪ������ʽ)��
���𰸡� 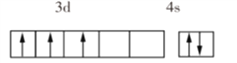 B �ṹ���ƣ���Է�������Խ���Ӽ�������Խ�е�Խ�� BF3��������ԭ���пչ�����������F-�й¶Ե��ӣ����γ���λ�� sp2��sp3
B �ṹ���ƣ���Է�������Խ���Ӽ�������Խ�е�Խ�� BF3��������ԭ���пչ�����������F-�й¶Ե��ӣ����γ���λ�� sp2��sp3  4 (1/4��1/4��1/4) 25��4/��NAa3����1030
4 (1/4��1/4��1/4) 25��4/��NAa3����1030
��������������Ҫ�������ʽṹ��
(1)��̬��ԭ�ӵļ۵����Ų�ͼΪ ��
��
(2)һ��ǽ�����Խǿ����һ������Խ�ǽ����ԣ�B<C<N<O���������ڵ�ԭ���������Ӵ��ڰ�����Ľ��ȶ�״̬��ʹ�õ��ĵ�һ�����ܴ�����������B��C��N��O����Ԫ�ص�һ��������С�����˳��ΪB<C<O<N��
(3)������±����е��������ߵ�ԭ���ǽṹ���ƣ���Է�������Խ���Ӽ�������Խ�е�Խ����
����BF3���ӽṹ���ͷ�ӦBF3(g)+NH4F(s)=NH4BF4(s)�ܹ�������ԭ��BF3��������ԭ���пչ�����������F-�й¶Ե��ӣ����γ���λ����
��BCl3��LiBH4����ԭ�ӵ��ӻ������������Ϊsp2��sp3����B3N3H6��Ϊ�ȵ�����ķ��ӵĽṹ��ʽΪ ��
��
(4)�پ�����ÿ����ԭ����Χ��������ҵȾ������ԭ����4����
�ڿɽ����½�Bԭ������ΪB(0��0��0)����ͼ��֪������������Bԭ������ҵȾ����Nԭ�ӵ��������Ϊ(1/4��1/4��1/4)��
�۾�������4��Bԭ�Ӻ�4��Nԭ�ӣ����ǵ����ԭ������֮��Ϊ100���������Ϊa3��1030cm3����������ܶ�Ϊ100/ ( NAa3)��1030g��cm-3��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϯ��������G�ڴ���ҩ��²��ϵȷ����й㷺Ӧ�á��ϳ�G��һ��·�����£�
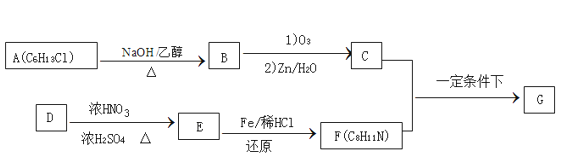
��֪������Ϣ��
��
��1 mol B��������Ӧ����2 mol C����C���ܷ���������Ӧ
��D���ڵ�ȡ������������Է�������Ϊ106
�ܺ˴Ź���������ʾF�����������ֻ�ѧ��������
��![]()
�ش��������⣺
(1)��A����B�ķ�Ӧ����Ϊ____________
(2)D�Ļ�ѧ������____________����D����E�Ļ�ѧ����ʽΪ�� ______
(3)G�Ľṹ��ʽΪ____________
(4)F��ͬ���칹���к��б����Ļ���____�֣������������칹�������к˴Ź�����������4��壬�������Ϊ6��2��2��1����_______����д�����е�һ�ֵĽṹ��ʽ����
(5)�ɱ��ͻ�����C�����²���ɺϳ�N-�����������

��Ӧ����1��ѡ����Լ�Ϊ__________����Ӧ����2��ѡ����Լ�Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A.̼��������ᷴӦ��CO32��+H+�TH2O+CO2
B.����ϡ���ᷴӦ��2Fe+6H+�T2Fe3++3H2
C.����������������Ӧ��OH��+H+�TH2O
D.ͭƬ������������Һ�У� Cu+Ag+=Cu2++Ag
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ������и��ֻ�ѧ����ͼ��ʾ,�����Ҵ��ڸ��ַ�Ӧ�ж��Ѽ���˵������ȷ���� (����)
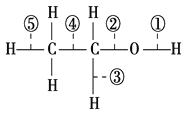
A. �ͽ����Ʒ�Ӧʱ���ٶ���
B. ��ŨH2SO4���ȵ�170 ��ʱ���ں͢ݶ��ѣ���ŨH2SO4���ȵ�140 ��ʱ���٢ڶ���
C. �Ҵ�����������ȫȼ�գ����٢ڶ���
D. ��Ag������O2��Ӧʱ���ٺ͢۶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Se���ƹ��ص�һ��ԭ�ϡ����ͭ���������к���3%-14%��SeԪ��(SeԪ����Se���ʺ�Cu2Se����ʽ����)��������ϡ�н������������������������ȡSe���������£�
![]()
��ش��������⣺
(1)Ũ�����ܽ�Cu2Se����CuSO4��SO2��SeO2�Ļ�ѧ����ʽΪ__________________��
(2)���̢ڵ�Ŀ����_____________________��
(3)���̢ܵIJ���������_____________________��
(4)SO2��SeO2(g)��Ӧ�����ӷ���ʽΪ________________������������ȡSe�Ĺ������̿�֪��SeO2��H2SO4(Ũ)��SO2����������ǿ������˳����_____________��
(5)��ҵ��ȡSe�������У���ѭ�����õ�������________________��(�ѧʽ)
(6)�ٳ�ȡ5.000g���ͭ��������Ʒ���Ժ��ʷ����ܽ⣬���250.0mL������Һ
����ȡ������Һ25.00mL����ƿ�У�����30.0mL0.0100mol/LKMnO4����Һ(Se��+4��ת��Ϊ+6��)��
�۷�Ӧ��ȫ����0.05000mol/L(NH4)2Fe(SO4)2����Һ�����յ㣬����(NH4)2Fe(SO4)2����Һ10.00mL��
����ͭ��������Ʒ��Se����������Ϊ__________________������FeCl2����Һ����(NH4)2Fe(SO4)2����Һ���еζ����ԲⶨSe�������������__________(�䡰ƫ�ߡ���ƫ�͡��� ��Ӱ�족)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ�ã�ͨ�����Cu��������Һ��ɫ�������˵����ȷ����(����)
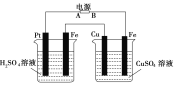
A. A��������Cu����
B. ���ձ���Һ�����ձ���Һ��pH����С
C. ���ձ���ҺŨ�ȱ�����ձ���ҺŨ�Ȳ���
D. ���ձ�Pt�������ձ�Fe���ĵ��������ʵ���֮��Ϊ1:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ���ܴ����������(����)
A.K����Cu2����Na����Cl��
B.H����Na����NO3-��HCO3-
C.Ba2����H����NO3-��SO42-
D.Mg2����Na����OH����SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.�Ƶ�Ħ�����������������ԭ������
B.CH4��Ħ������Ϊ16 g/mol
C.22.4 L�κ���������ʵ�����Ϊ1 mol
D.1 mol �κ����ʾ�����NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й������ĸ����õ绯ѧװ�õ�������ȷ����(����)
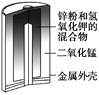
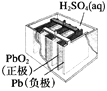
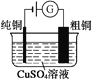
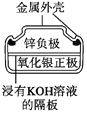
ͼ1������п�̵�� ͼ2��Ǧ���������� ͼ3����⾫��ͭ ͼ4����пŦ�۵��
A. ͼ1��ʾ����У�MnO2�������Ǵ���
B. ͼ2��ʾ��طŵ�����У�����Ũ�Ȳ�������
C. ͼ3��ʾװ�ù��������У��������Һ��Cu2+Ũ��ʼ�ղ���
D. ͼ4��ʾ����У�Ag2O������������ع��������л�ԭΪAg
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com