
【题目】乙醇分子中各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是 ( )
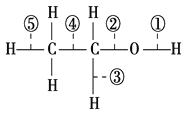
A. 和金属钠反应时键①断裂
B. 和浓H2SO4共热到170 ℃时键②和⑤断裂,和浓H2SO4共热到140 ℃时键①②断裂
C. 乙醇在氧气中完全燃烧,键①②断裂
D. 在Ag催化下与O2反应时键①和③断裂
科目:高中化学 来源: 题型:
【题目】采用如下装置(夹持和加热仪器已略去)电解饱和食盐水,并检验氯气的氧化性,同时用电解产生的H2还原CuO粉末来测定Cu的相对原子质量。

(1)写出电解饱和食盐水的离子方程式_________________________________。
(2)为完成上述实验,正确的连接顺序为A连_______;B连_______ (填写导管口字母)。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是下列试剂中的___________。
a.酸性高锰酸钾溶液 b.淀粉碘化钾溶液 c.亚硫酸钠溶液 d.氯化亚铁溶液
(4)丙装置的c瓶中盛放的试剂为___________,作用是______________________。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案:
精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g(假设CuO充分反应),实验完毕后:
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量。
乙方案:通过精确测定U型管b反应前后的质量变化,得到生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:___________方案所测结果更准确。若按合理方案测定的数据计算,Cu的相对原子质量为________________。
②不合理的方案会造成测定结果___________(填“偏低、偏高或无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”的电化学实验装置如图所示。该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法错误的是

A. 该装置工作时,H+从b极区向a极区迁移
B. a电极的反应为:3CO2+18H++18e-=C3H8O+5H2O
C. 每生成1molO2,有44gCO2被还原
D. C3H8O形成燃料电池以氢氧化钠作为电解质溶液的负极反应式:C3H8O-18e-+24OH-=3CO32-+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO的燃烧热为akJ/mol,将CO燃烧产物通入一定浓度的NaOH溶液中,所得溶液中溶质仅为Na2CO3,浓度为0.01mol/L。
(1)写出CO完全燃烧的热化学方程式__________________________;
(2)Na2CO3溶液呈碱性,可以用来去油污,用离子方程式表示Na2CO3呈碱性的原因___________________________________;
(3)写出Na2CO3溶液中的电荷守恒关系__________;(用离子浓度符号表示)
(4)计算在该浓度的Na2CO3溶液中c(CO32-)+c(HCO3-)+c(H2CO3)=____mol/L
(5)向该溶液中滴加AlCl3溶液,会有气泡和白色沉淀生成,写出发生反应的离子方程式__________________________。
(6)已知Cu(OH)2的溶度积为Ksp=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________;要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组模拟工业上海水提溴,设计如下实验。 回答下列问题:
Ⅰ. 利用如图所示装置富集溴:
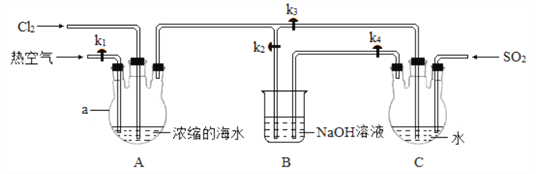
实验步骤:
①关闭 k1、k3,打开k2,向装置A 中通入足量Cl2,充分反应;
②停止通Cl2,关闭k2,打开 k1、k3 和k4, 向装置A 中通入足量热空气,同时向装置C中通入足量SO2,充分反应;
③停止通气体,关闭k1、k4。
(1)a 的名称为___________。
(2) 步骤①中主要反应的离子方程式为_____________。
(3) 步骤②中通入热空气的作用为_______。 装置 C 发生富集溴的反应中,氧化剂与还原剂的物质的量之比为____________;实际参加反应的SO2 的物质的量大于理论值,主要原因为_____________(用化学方程式表示)。
Ⅱ.制备溴:
富集溴的过程结束后,继续向装置 C 中通入 Cl2,充分反应后蒸馏。
(4)下列蒸馏装置正确的是_____(填选项字母)。

(5) 装置 A 中加入V mL 含 Br-的浓度为 c mol·L-1的浓缩海水,蒸馏所得溴单质的质量为 m g, 则该实验中溴单质的产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在材料制造、有机合成等方面用途非常广泛。回答下列问题:
(1)VB2是一种导电陶瓷材料,基态钒原子的价电子排布图为___________
(2)B、C、N、O四种元素第一电离能由小到大的顺序为_______________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示:
卤化物 | BF3 | BCl3 | BBr3 | BI3 |
沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是_________________。
②用BF3分子结构解释反应BF3(g)+NH4F(s)=NH4BF4(s)能够发生的原因:_________________。
③制备环硼氨烷的方法如下:
![]()
BCl3、LiBH4中硼原子的杂化轨道类型依次为_________________;与B3N3H6互为等电子体的分子的结构简式为___________________。
(4)立方氮化硼的晶胞结构与金刚石结构相似(如下图),是超硬材料。

①晶胞中每个氮原子周围与其最近且等距离的硼原子有_____个;
②结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,立方氮化硼的晶胞中, B原子的坐标参数分别有:B(0,0,0),B(![]() ,0,
,0, ![]() );B(0,
);B(0, ![]() ,
, ![]() )等,则距离上述三个B原子最近且等距离的N原子的坐标参数为___________________。
)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为___________________。
③已知氮化硼晶胞边长为apm,则氮化硼晶体的密度为____g·cm-3(设NA为阿伏加德罗常数值,只要求列算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的说法正确的是
A. 向NH4Cl溶液中加入NaOH溶液至呈中性,溶液中c(Na+)=c(NH3·H2O)
B. 用少量水稀释0.1mol·L-1氨水时;溶液中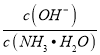 减小
减小
C. 将Na2CO3溶液从20℃升温至30℃,溶液中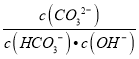 增大
增大
D. pH=5.5的CH3COOH与CH3COONa混合溶液中c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、X、Y和Z是原子序数依次递增的短周期元素。其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子的化合物;B与Z的最外层电子数之比为2∶3,常见化合物Y2X2与水反应生成X的单质,其水溶液可使酚酞试液变红。请回答下列问题:
(1)Z元素在元素周期表中的位置是_____________________。
(2)化合物B2A4的结构式为____________________。
(3)A与X、A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为_____
(4)将Z与X形成的气态化合物ZX2通入Ba(NO3)2溶液中,有白色沉淀和NO气体生成,发生反应的离子方程式为________________________________________________,由此可得出NO与ZX2的还原性大小关系为________________(填相应化学式)。
(5)将Y2X2投入到Y2Z的水溶液中可生成Z的单质,发生反应的化学方程式为________。
(6)两种均含A、X、Y、Z四种元素的化合物相互反应放出气体的离子反应方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com