
【题目】CO的燃烧热为akJ/mol,将CO燃烧产物通入一定浓度的NaOH溶液中,所得溶液中溶质仅为Na2CO3,浓度为0.01mol/L。
(1)写出CO完全燃烧的热化学方程式__________________________;
(2)Na2CO3溶液呈碱性,可以用来去油污,用离子方程式表示Na2CO3呈碱性的原因___________________________________;
(3)写出Na2CO3溶液中的电荷守恒关系__________;(用离子浓度符号表示)
(4)计算在该浓度的Na2CO3溶液中c(CO32-)+c(HCO3-)+c(H2CO3)=____mol/L
(5)向该溶液中滴加AlCl3溶液,会有气泡和白色沉淀生成,写出发生反应的离子方程式__________________________。
(6)已知Cu(OH)2的溶度积为Ksp=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________;要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液pH为________。
【答案】 2CO(g)+O2(g)=2CO2(g) △H=-2akJ/mol CO32- + H2O ![]() HCO3- + OH- c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) 0.01 2Al3+ + 3CO32++3H2O=2Al(OH)3↓+3CO2↑ 5 6
HCO3- + OH- c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) 0.01 2Al3+ + 3CO32++3H2O=2Al(OH)3↓+3CO2↑ 5 6
【解析】(1)CO的燃烧热为akJ/mol,CO完全燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g) △H=-2akJ/mol或CO(g)+ ![]() O2(g)=CO2(g) △H=-akJ/mol,故答案为:2CO(g)+O2(g)=2CO2(g) △H=-2akJ/mol或CO(g)+
O2(g)=CO2(g) △H=-akJ/mol,故答案为:2CO(g)+O2(g)=2CO2(g) △H=-2akJ/mol或CO(g)+ ![]() O2(g)=CO2(g) △H=-akJ/mol;
O2(g)=CO2(g) △H=-akJ/mol;
(2)Na2CO3溶液中CO32-水解,CO32-+H2O![]() HCO3-+OH-,使Na2CO3溶液呈碱性,故答案为:CO32-+H2O
HCO3-+OH-,使Na2CO3溶液呈碱性,故答案为:CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
(3)Na2CO3溶液中存在的CO32-水解,且以第一步水解为主,溶液中存在的离子有:H+、Na+、OH-、HCO3-、CO32-,电荷守恒关系为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故答案为:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-);
(4)Na2CO3溶液中存在物料守恒c(Na+)=2c(HCO3-)+2c(CO32-)+ 2c(H2CO3),则c(CO32-)+c(HCO3-)+c(H2CO3)= ![]() c(Na+)=0.01mol/L×2×
c(Na+)=0.01mol/L×2×![]() =0.01mol/L,故答案为:0.01;
=0.01mol/L,故答案为:0.01;
(5)向碳酸钠溶液中滴加AlCl3溶液,发生双水解反应,有二氧化碳和氢氧化铝沉淀生成,反应的离子方程式为2Al3+ + 3CO32++3H2O=2Al(OH)3↓+3CO2↑,故答案为:2Al3+ + 3CO32++3H2O=2Al(OH)3↓+3CO2↑;
(6)如生成沉淀,应满足c(Cu2+)×c2(OH-)>2×10-20,c(Cu2+)=0.02mol/L,则c(OH-)=![]() mol/L=10-9mol/L,则c(H+)=10-5mol/L,pH=5,故答案为:5;
mol/L=10-9mol/L,则c(H+)=10-5mol/L,pH=5,故答案为:5;
(7)使0.2molL-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则c(Cu2+)=2×10-4mol/L,则c(OH-)=![]() mol/L=10-6mol/L,则c(H+)=10-6mol/L,pH=6,故答案为:6。
mol/L=10-6mol/L,则c(H+)=10-6mol/L,pH=6,故答案为:6。


科目:高中化学 来源: 题型:
【题目】锂海水电池常用在海上浮标等助航设备中,其示意图如图所示。电池反应为2Li+2H2O===2LiOH+H2↑。电池工作时,下列说法错误的是( )

A. 金属锂作负极
B. 电子从锂电极经导线流向镍电极
C. 可将电能转化为化学能
D. 海水作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用新方案和新工艺处理废旧铅酸蓄电池,可以达到节能减排、防治污染和资源循环利用的目的。一种处理铅酸蓄电池的流程如下:

已知:Ksp(PbSO4)=1.6×10-8)和Ksp(PbCO3)=7.4×10-14
(1)写出铅酸蓄电池放电时的总反应____________________________________________;
(2)废旧电池的预处理时需要将电池放电完全,目的是____________________________;
(3)写出铅膏脱硫时的离子方程式____________________________________________。
(4)传统的铅蓄电池的处理工艺是将电池破碎后,洗涤,干燥,直接送入回转炉熔炼。而该工艺使用纯碱脱硫的显著优点是________________________________________。
(5)从Na2SO4溶液中结晶出Na2SO4·10H2O晶体的方法是蒸发浓缩、___________、过滤洗涤,洗涤时用乙醇洗涤晶体,用乙醇而不用水洗涤的原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.碳酸钙与盐酸反应:CO32﹣+H+═H2O+CO2
B.铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2
C.硝酸与氢氧化钡反应:OH﹣+H+═H2O
D.铜片插入硝酸银溶液中: Cu+Ag+=Cu2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等量的CO(g)和H2O(g)分别通入到容积为2 L的恒容密闭容器中进行如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到下列数据:
CO2(g)+H2(g),得到下列数据:
实验组 | 温度 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
H2O | CO | H2 | |||
1 | 650 | 2 | 4 | 1.6 | 5 |
2 | 900 | 2 | 4 | 0.9 | t |
①在实验1中,以v(CO2)表示该反应前5分钟的平均反应速率为________; __________;平衡时的压强和反应开始的压强之比为__________。
②在实验2中,t________5(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是 ( )
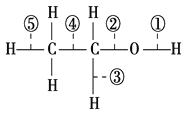
A. 和金属钠反应时键①断裂
B. 和浓H2SO4共热到170 ℃时键②和⑤断裂,和浓H2SO4共热到140 ℃时键①②断裂
C. 乙醇在氧气中完全燃烧,键①②断裂
D. 在Ag催化下与O2反应时键①和③断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Se是制光电池的一种原料。电解铜的阳极泥中含有3%-14%的Se元素(Se元素以Se单质和Cu2Se的形式存在),还含有稀有金属及贵金属。从阳极泥中提取Se的流程如下:
![]()
请回答下列向题:
(1)浓硫酸溶解Cu2Se生成CuSO4、SO2、SeO2的化学方程式为__________________。
(2)流程②的目的是_____________________。
(3)流程④的操作名称是_____________________。
(4)SO2与SeO2(g)反应的离子方程式为________________。根据上述提取Se的工艺流程可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_____________。
(5)工业提取Se的流程中,可循环利用的物质是________________。(填化学式)
(6)①称取5.000g电解铜阳极泥样品。以合适方法溶解,配成250.0mL混酸溶液
②移取上述溶液25.00mL于锥形瓶中,加入30.0mL0.0100mol/LKMnO4标准溶液(Se由+4价转化为+6价)。
③反应完全后,用0.05000mol/L(NH4)2Fe(SO4)2标准溶液滴至终点,消耗(NH4)2Fe(SO4)2标准溶液10.00mL。
则电解铜阳极泥样品中Se的质量分数为__________________。若用FeCl2标准溶液代替(NH4)2Fe(SO4)2标准溶液进行滴定,对测定Se的质量分数结果__________(其“偏高”或“偏低”“ 无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在透明溶液中能大量共存的是( )
A.K+、Cu2+、Na+、Cl-
B.H+、Na+、NO3-、HCO3-
C.Ba2+、H+、NO3-、SO42-
D.Mg2+、Na+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为Y2X3(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A. 原子半径:Y>Z>R>T B. 气态氢化物的稳定性:W<R<T
C. 最高价氧化物对应的水化物的碱性:X>Z D. XR2、WR2两种化合物中R的化合价相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com