
分析 设出混合物中镁和铝的物质的量,然后分别根据总质量、电子守恒列式计算,最后根据m=nM计算出合金中二者的质量之比.
解答 解:设合金中含有Mg、Al的物质的量分别为x、y,
根据合金的总质量可得:24x+27y=2,
根据电子守恒可知:2x+3y=$\frac{2.24}{22.4}$×2,
联立解得:x=$\frac{1}{30}$mol、y=$\frac{2}{45}$mol,
所以合金中镁、铝的质量之比为:($\frac{1}{30}$mol×24g/mol):$\frac{2}{45}$mol×27g/mol=2:3,
答:镁、铝的质量比为2:3.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握质量守恒定律、电子守恒在化学计算中的应用,试题培养了学生的化学计算能力.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 欲配制100ml 1.0mol/L Na2SO4溶液,下列说法正确的是( )
欲配制100ml 1.0mol/L Na2SO4溶液,下列说法正确的是( )| A. | ②④ | B. | ②③ | C. | ①③ | D. | 以上都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定终点的pH值一定等于7 | |
| B. | 滴定实验中锥形瓶不可用待测液润洗 | |
| C. | 滴定实验中,KMnO4溶液应放在碱式滴定管中 | |
| D. | 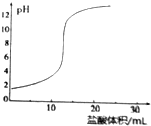 用盐酸滴定NaOH溶液的滴定曲线如图所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
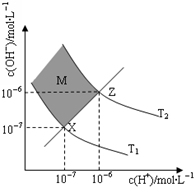 醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com