
分析 (1)操作步骤有计算、称量、溶解、恢复室温、移液、洗涤移液、定容、摇匀等操作;
(2)使用容量瓶之前应检查是否漏水;
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{V}$分析判断.
解答 解:(1)操作步骤有计算、称量、溶解、恢复室温、移液、洗涤移液、定容、摇匀等操作,
故答案为:定容;
(2)使用容量瓶之前应检查是否漏水,
故答案为:检查是否漏液;
(3)①烧杯、玻璃棒未进行洗涤,少量碳酸钠沾在烧杯壁与玻璃棒上,移入容量瓶中碳酸钠的实际质量减小,所配溶液浓度偏低,
故答案为:偏低;
②最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响,
故答案为:无影响.
点评 本题考查了一定物质的量浓度溶液的配制,注意根据c=$\frac{n}{V}$理解配制原理,注意碳酸钠称量应在玻璃器皿内称量.


 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 3.48 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 1.58 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 消耗盐酸的体积/mL | 待测KOH溶液的体积/mL |
| 1 | 27.23 | 25.00 |
| 2 | 28.24 | 25.00 |
| 3 | 27.25 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和10mL 1 mol•L-1 CH3COOH溶液需要10 mL 1 mol•L-1 NaOH溶液 | |
| B. | 物质的量浓度相同时,锌粒跟盐酸反应的速率比跟醋酸反应的速率快 | |
| C. | 0.01mol•L-1醋酸溶液的pH大于2 | |
| D. | 0.1mol•L-1 CH3COONa溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HB-+A-═HA+B2- | B. | H3C+3A-═3HA+C3- | ||
| C. | H3C+B2-═HB-+H2C- | D. | H3C+3OH-═3H2O+C3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度和体积都相同的盐酸和醋酸溶液,在与足量锌反应时,起始时二者产生H2速率基本相等 | |
| B. | 100mL1mol•L-1的盐酸和50mL2mol•L-1的盐酸,分别与足量的锌反应时,两者放出H2速率和质量均相等 | |
| C. | 100mLpH=3的H2SO4和HCl溶液,与足量锌反应后,放出H2的质量相等 | |
| D. | 100mLpH=3的盐酸与醋酸溶液,与足量锌反应后,所得H2的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
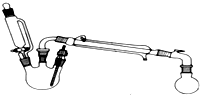 某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)
某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H2R是二元弱酸,其Kal=1×10-2 | |
| B. | 当溶液恰好呈中性时,c(Na+)=2c(R2-)+c(HR-) | |
| C. | NaHR在溶液中水解倾向大于电离倾向 | |
| D. | 含Na2R与NaHR各0.1mol的混合溶液的pH=7.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com