
【题目】已知:锂离子电池的总反应为:LixC+Li1-xCoO2![]() C+LiCoO2锂硫电池的总反应为:2Li+S
C+LiCoO2锂硫电池的总反应为:2Li+S![]() Li2S。有关上述两种电池说法正确的是
Li2S。有关上述两种电池说法正确的是
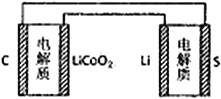
A. 锂离子电池放电时,Li+向负极迁移 B. 锂硫电池充电时,锂电极发生还原反应
C. 理论上两种电池的比能量相同 D. 右图表示用锂离子电池给锂硫电池充电
【答案】B
【解析】A项,锂离子电池放电时,外电路中电子从负极流向正极,内电路中阴离子从正极流向负极,外电路中电流与电子方向相反,内电路中阳离子与阴离子移动方向相反,所以阳离子向正极移动,故A错误;B项,锂硫电池充电时Li2S发生反应生成S和Li,Li的化合价由+1价降到0价,所以锂电极上发生还原反应,故B正确;C项,比能量是参与电极反应的单位质量的电极材料放出电能的大小,锂硫电池放电时负极为Li,锂离子电池放电时负极为LixC,两种电池的负极材料不同,所以比能量不同,故C错误;D项,锂硫电池的正极是S,负极是Li,锂离子电池负极反应为:LixC-xe-=C+xLi+,正极反应为:Li1-xCoO2+xLi++xe-=LiCoO2,所以图中LiCoO2一端是正极,C一端是负极,所以用锂离子电池给锂硫电池充电,锂离子电池负极接原锂硫电池的负极,即C电极应连接Li电极,故D错误。


科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
如下图,A是单质,B为淡黄色固体。
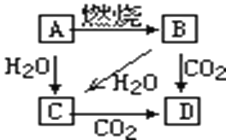
写出下列转化的化学方程式为:
(1)A→ B______________________________
(2)B→ D______________________________
(3)B→ C______________________________
(4)A→C_______________________________
(5)A与硫酸铜溶液反应_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl26H2O是一种饲料营养强化剂。可由水钴矿[主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等]制取,其工艺流程如下:
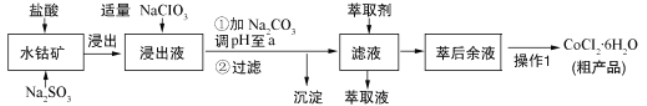
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等.
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl26H2O熔点为86℃,加热至110﹣120℃时,失去结晶水生成CoCl2.
回答下列问题:
(1)浸出水钴矿过程中,Fe2O3发生反应的化学方程式为________________________。
(2)向浸出液中加入适量NaClO3目的是______________________________________。
(3)“加Na2CO3调pH至a”,a=______;过滤所得沉淀的主要成分为_________(填化学式)。
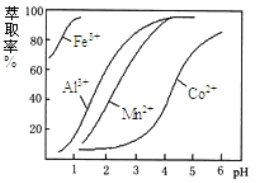
(4)萃取剂对金属离子的萃取与溶液pH的关系如下图所示,向“滤液”中加入该萃取剂的目的是__________,使用该萃取剂的最佳pH范围是_____(填选项字母)
A. 5.0﹣5.5 B. 4.0﹣4.5 C. 3.0﹣3.5 D. 2.0﹣2.5
(5)实验操作“操作1”为_______________、_________、过滤和减压烘干;制得的CoCl26H2O在烘干时需减压烘干的原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X常被用于制香料或作为饮料酸化剂,在医学上也有广泛用途。物质X的结构简式如下图所示,下列关于物质X的说法正确的是( )
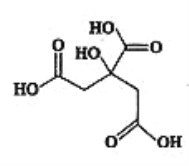
A. X的分子式为C6H7O7
B. X不能发生消去反应,但能发生水解反应
C. 1mol物质X最多可以和4molNaOH发生反应
D. 足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制0.2mol/L 的NaOH溶液980mL,有以下仪器:
①烧杯 ②100mL量筒 ③托盘天平(带砝码) ④玻璃棒 ⑤胶头滴管
(1)配制时,必须使用的仪器有___________(填代号),还缺少的玻璃仪器是 ________。该实验中两次用到玻璃棒,其作用分别是_______________,_________________。
(2)使用容量瓶前必须进行的一步操作是_____________________。
(3)配制溶液时,一般可以分为以下几个步骤:正确的操作顺序是:_______________(用字母表示,每个字母只能用一次);
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.用托盘天平准确称取所需的NaOH固体的质量,放入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的溶液沿玻璃棒注入1000mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
在①操作中需称量NaOH_______g
(4)请你分析下列哪些操作会引起所配浓度偏大(填写字母)___________________。
A.将NaOH放在滤纸上称量
B.称取NaOH的砝码已生锈
C.容量瓶未干燥即用来配制溶液
D.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容;
E.往容量瓶转移时,有少量液体溅出
F.在容量瓶中定容时视线如下图所示

G.烧杯未进行洗涤
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
(5)若定容时不小心使液面超过了刻度线,应采取的措施是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)在25℃、101kPa下,1gCH3OH(l)燃烧生成CO2(g)和H2O(l)时放热22.68kJ。则CH3OH燃烧的热化学方程式为_________________________。
(2)若以(1)中反应原理设计成甲醇燃料电池,电解质溶液为20%~30%的 KOH溶液,则该燃料电池的负极电极反应式为_________________________。
(3)将pH=3的CH3COOH溶液稀释100倍后,溶液的pH范围是____________;将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,溶液显____性(填“酸”、“碱”或“中”)
(4)某温度下,反应2NH3(g)![]() N2(g)+3H2(g)于恒容密闭容器中达到平衡状态。若某时刻向该容器内通入一定量氨气,则化学平衡________移动(填“正向”、“逆向”或“不”)。若某时刻容器内所有物质的浓度均增加为原来的2倍,则化学平衡________移动(填“正向”、“逆向”或“不”)。
N2(g)+3H2(g)于恒容密闭容器中达到平衡状态。若某时刻向该容器内通入一定量氨气,则化学平衡________移动(填“正向”、“逆向”或“不”)。若某时刻容器内所有物质的浓度均增加为原来的2倍,则化学平衡________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯碱工业是以惰性电极电解饱和食盐水,制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
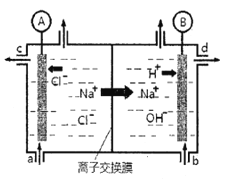
完成下列填空:
①写出电解饱和食盐水的离子方程式_________。
②离子交换膜的作用为:__________、__________。
③氢氧化钠溶液从图中_____位置流出。(选填a、b、c或d)
(2)已知在强碱性环境中,Fe(OH)3可与KClO溶液作用而生成FeO42-。
①此反应的离子方程式是_________。
②高铁电池是一种新型的充电电池,总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,放电时每转移6mol电子,有_____mol K2FeO4被还原,放电时负极附近溶液的pH_________ (填增大”、“减小”或“不变”); 充电时阳极反应式为:_____。
3Zn(OH)2+2Fe(OH)3+4KOH,放电时每转移6mol电子,有_____mol K2FeO4被还原,放电时负极附近溶液的pH_________ (填增大”、“减小”或“不变”); 充电时阳极反应式为:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com