
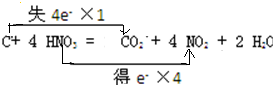 ,故答案为:
,故答案为: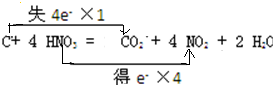 ;
;| 0.4mol |
| 4 |


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | ||
| B、由水电离的c(H+)=1×10-14 mol?L-1的溶液中:Ca2+、K+、Cl-、CH3COO- | ||
| C、c(Fe3+)=0.1 mol?L-1的溶液中:K+、ClO-、SO42-、SCN- | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
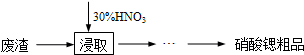
| 温度/℃物质 | 0 | 20 | 30 | 45 | 60 | 80 | 100 |
| Sr(NO3)2 | 28.2 | 40.7 | 47 | 47.2 | 48.3 | 49.2 | 50.7 |
| Ca(NO3)2?4H2O | 102 | 129 | 152 | 230 | 300 | 358 | 408 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
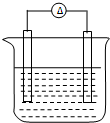 铁片和铜片浸入200mL CuSO4溶液中组成如图所示原电池,若开始时该电池中两电极的总质量为60克,工作一段时间后,硫酸铜恰好反应完.取出铁片和铜片,洗净干燥后称重,总质量为61.6克,试计算:(不考虑铁片直接和硫酸铜的反应)
铁片和铜片浸入200mL CuSO4溶液中组成如图所示原电池,若开始时该电池中两电极的总质量为60克,工作一段时间后,硫酸铜恰好反应完.取出铁片和铜片,洗净干燥后称重,总质量为61.6克,试计算:(不考虑铁片直接和硫酸铜的反应)查看答案和解析>>
科目:高中化学 来源: 题型:
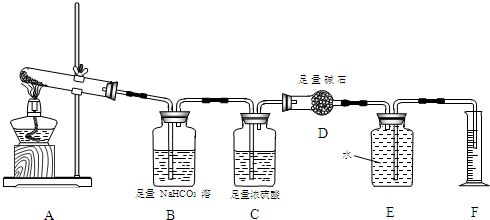
查看答案和解析>>
科目:高中化学 来源: 题型:
| 35.84L |
| 22.4L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
| B、氢氧化铜和稀盐酸溶液反应:H++OH-═H2O |
| C、锌粒溶于醋酸溶液:Zn+2H+═Zn2++H2↑ |
| D、往盐酸中滴加少量Na2CO3溶液:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com