
| 35.84L |
| 22.4L/mol |
| 35.84L |
| 22.4L/mol |
| 35.84L |
| 22.4L/mol |
|
|


科目:高中化学 来源: 题型:
| A、元素气态氢化物的稳定性 |
| B、元素单质熔、沸点高低 |
| C、金属间发生的置换 |
| D、非金属阴离子的还原性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类标准 | 电解质 | 盐 | 非电解质 | 混合物 |
| 属于该类 的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
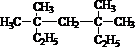 系统命名为
系统命名为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性HClO4>H2SO4>H3PO4>H2CO3 |
| B、稳定性H2S>HCl>HBr>HI |
| C、粒子半径Br->K+>S2->S |
| D、还原性Na>Br->Cl->S2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com