锶(Sr)是人体必需的微量元素,其单质和化合物的化学性质与钙、钡的相似.实验室用含碳酸锶的废渣(含SrCO
3 38.40%,SrO12.62%,CaCO
3 38.27%,BaCO
3 2.54%,其它不溶于硝酸的杂质8.17%)制备硝酸锶粗品的部分实验过程如下:
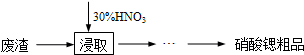
(1)市售浓硝酸的质量分数为65%,密度为1.4g/cm
3,要配制30%稀硝酸500mL,还需要查阅的数据是
,若配制过程中不使用天平,则必须要计算的数据是
,必须要使用的仪器是
.
已知两种盐的溶解度(g/100g水)如表所示:
| 温度/℃物质 | 0 | 20 | 30 | 45 | 60 | 80 | 100 |
| Sr(NO3)2 | 28.2 | 40.7 | 47 | 47.2 | 48.3 | 49.2 | 50.7 |
| Ca(NO3)2?4H2O | 102 | 129 | 152 | 230 | 300 | 358 | 408 |
(2)由浸取后得到的混合物制备硝酸锶粗品的实验步骤依次为:过滤、
、
、洗涤,干燥.
(3)已知,硝酸钙能溶于有机溶剂A中.式量:Sr(NO
3)
2-212、Ba(NO
3)
2-261、Ca(NO
3)
2-164
制得的硝酸锶粗品中含少量Ca(NO
3)
2、Ba(NO
3)
2等杂质.测定硝酸锶纯度的实验如下:取5.39g硝酸锶样品,加入足量的有机溶剂A,经过滤、洗涤、干燥后,剩余固体5.26g,将此固体配成250mL的溶液,取出25.00mL,调节pH为7,加入指示剂,用浓度为0.107mol/L的碳酸钠溶液滴定至终点,消耗碳酸钠溶液22.98mL.滴定过程的反应:Sr
2++CO
32-→SrCO
3↓,Ba
2++CO
32-→BaCO
3↓.
①滴定选用的指示剂为
,滴定终点观察到的现象为
.
②该硝酸锶粗品中,硝酸锶的质量分数为
(小数点后保留两位).若滴定前样品中Ca(NO
3)
2没有除尽,所测定的硝酸锶纯度将会
(填“偏高”、“偏低”或“不变”).


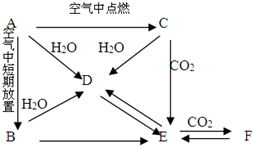 A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体.它们按如图所示的关系相互转化,已知A为单质.分别写出有关反应的化学方程式.
A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体.它们按如图所示的关系相互转化,已知A为单质.分别写出有关反应的化学方程式.