
CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体直接排入空气中会引起酸雨的有 。
(2)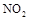 可用尿素
可用尿素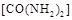 还原(尿素中C元素的化合价为+4价),反应的方程式为:
还原(尿素中C元素的化合价为+4价),反应的方程式为: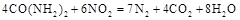 。当消耗掉12g尿素时,转移电子的物质的量是 。
。当消耗掉12g尿素时,转移电子的物质的量是 。
(3)SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的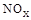 ),改流程中发生的主要反应有:
),改流程中发生的主要反应有: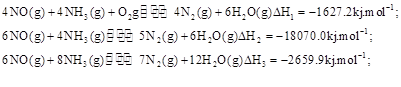
则反应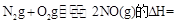 KJ/mol
KJ/mol
(4)CO可用于合成甲醇,反应方程式为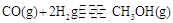 。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
则该反应是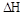 0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为 L。
0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为 L。
(5)工业上用氨水将来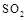 转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为 ;已知25℃时,0.05mol/L(NH4)2SO4溶液的
转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为 ;已知25℃时,0.05mol/L(NH4)2SO4溶液的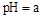 ,则
,则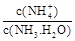 = (用含a的代数式表示,已知
= (用含a的代数式表示,已知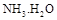 的电离常数
的电离常数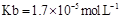 )。
)。
(1)NO、NO2、SO2(2分)
(2)1.2 mol(2分)
(3)179.8(2分)
(4)<(2分) 2(2分)
(5)c(NH4+)>c(SO42-)>c(H+)>c(OH-)(2分) 1.7×109-a (2分)
解析试题分析:(1)酸雨分为硝酸型酸雨和硫酸型酸雨,所以NO、NO2、SO2都会引起酸雨。(2)尿素中C元素的化合价为+4价,反应中只有N元素变价,4molCO(NH2)2中-3价的N失去24mol电子,6molNO2中+4价的N得到24mol电子,生成7mol N2共转移24mol电子,则12g(0.2mol)尿素时消耗时,共转移1.2 mol电子。(3)求算反应N2(g)+O2(g)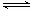 2NO(g)的ΔH,只用到前两个反应,ΔH1-ΔH2即可得到。(4)据图像可知,温度升高平衡逆向移动,所以ΔH<0。T1时,A点对应的α=0.5,据平衡常数表达式可得K=1。因B点与A点温度相同,K不变,可计算出体积为2L。(5)(NH4)2SO4溶液中NH4+水解显酸性,则离子浓度大小顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-);0.05mol·L-1(NH4)2SO4溶液的pH=a,则c(OH-)=10a-14,依据Kb的表达式和已知数据,可计算出结果为1.7×109-a。
2NO(g)的ΔH,只用到前两个反应,ΔH1-ΔH2即可得到。(4)据图像可知,温度升高平衡逆向移动,所以ΔH<0。T1时,A点对应的α=0.5,据平衡常数表达式可得K=1。因B点与A点温度相同,K不变,可计算出体积为2L。(5)(NH4)2SO4溶液中NH4+水解显酸性,则离子浓度大小顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-);0.05mol·L-1(NH4)2SO4溶液的pH=a,则c(OH-)=10a-14,依据Kb的表达式和已知数据,可计算出结果为1.7×109-a。
考点:本题以研究污染大气的有害气体性质为载体考查氧化还原反应、热化学反应、化学平衡及电解质溶液的相关知识。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:填空题
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚( CH3OCH3)。请回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) △H= -90.8kJ/mol
CH3OH(g) △H= -90.8kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) 的△H= ;
CH3OCH3(g)+CO2(g) 的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是:
________(填字母代号)。
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚(CH3OCH3)
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol·L-1) | 0.40 | 0.6 | 0.6 |
 _________
_________ (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知体积为2L的恒容密闭容器中发生反应: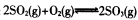 ,请根据化学反应的有关原理同答下列问题
,请根据化学反应的有关原理同答下列问题
(1)一定条件下,充入2 mol SO2(g)和2 mol O2(g),20 s后,测得SO2的体积百分含量为12.5%,则用SO2表示该反应在这20s内的反应速率为____,此时,该密闭容器内混合气体的压强是反应前的____倍。
(2)下面的叙述可作为判断(1)中可逆反应达到平衡状态依据的是(填序号)____。
①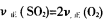
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④各气体的浓度都不再发生变化
(3)下图表示该反应的速率(v)随时间(t)的变化的关系。则下列不同时间段中,SO3的百分含量最高的是( )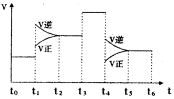

据图分析:你认为t3时改变的外界条件可能是 ;
t6时保持体积不变向体系中充人少量SO3,再次平衡后
SO2的体积百分含量比t6时 (填“大”\“小”或“等于”)。
(4)下图中P是可自由平行滑动的活塞。在相同温度时,向A容器中充入4 mol SO3(g),关闭K,向B容器中充入2 mol SO3(g),两容器分别发生反应。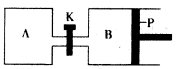
已知起始时容器A和B的体积均为aL。试回答:
①反应达到平衡时容器B的体积为1.2a L,容器B中SO3转
化率为____
②若打开K,一段时间后重新达到平衡,容器B的体积为 __L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(5)已知单质硫的燃烧热为△H=-296kJ/mol,经测定由S(s)生成120gSO3(g)可放热592.5kJ,请写出SO2(g)氧化生成SO3(g)的热化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
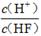 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
重晶石(BaSO4)是重要的化工原料,制备氢氧化钡晶体[Ba(OH)2·8H2O]的流程如下:
(1)写出煅烧时发生反应的热化学方程式:____________________________。
(2)写出氢氧化钡晶体与氯化铵晶体混合反应的化学方程式:_____________________。
(3)为检测煅烧时产生的CO,可将煅烧产生的气体通入PbCl2溶液中,出现黑色沉淀和产生一种无色无味能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式:_____。
(4)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3。发生的反应可表示为:
BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)
现有0.20 mol BaSO4,加入1.0L 2.0mol?L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0
平衡时,K=4.0x10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(写出计算过程结果保留2位有效数字)
(5)试从平衡的角度解释BaSO4可转化为BaCO3的原因:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢气是一种清洁、高效的新型能源。
I.用甲烷制取氢气的反应分为两步,其能量变化如下图所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
II.在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应。测得CO2的浓度随时间变化的图像如图: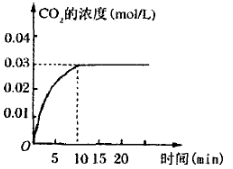
(2)在该温度下,从反应开始至达到平衡时,CO的平均反应速率为 ;
(3)该温度下,此反应的化学平衡常数为(可以用分数表示) ;
(4)下列改变中,能使平衡向正反应方向移动的是 。
| A.升高温度 | B.增大压强 |
| C.增大H2O(g)的浓度 | D.减少CO2(g)的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:H+(aq)+OH-(aq)= H2O(l) ΔH="-57.3" kJ/ mol,计算下列中和反应中放出的热量:
(1)用20 g NaOH配成的稀溶液跟足量的稀盐酸反应,能放出 kJ的热量。
(2)用0.1 mol Ba(OH)2配成的稀溶液跟足量的稀硝酸反应,能放出 kJ的热量。
(3)用1 mol醋酸稀溶液和足量NaOH稀溶液反应,放出的热量 (填“大于”、“小于”或“等于”)57.3 kJ,理由是 。
(4)1 L 0.1 mol/L NaOH溶液分别与①醋酸溶液、②浓硫酸、③稀硝酸恰好反应时,放出的热量分别为Q1、Q2、Q3(单位:kJ)。则它们由大至小的顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
(1) SiCl4的平均反应速率为___
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是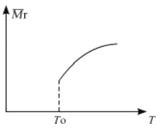
| A.该反应在任何温度下可自发进行 |
| B.若混合气体的总质量不变,表明上述反应己达到平衡状态 |
| C.其他条件不变,增大Si3N4的物质的量,平衡向左移动 |
| D.按3:2:6的物质的量比增加反应物,SiC14(g)的转化率降低 |

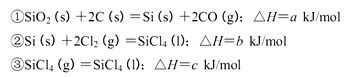
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。
反应①②③为_________反应(填“吸热”或“放热”)。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为__________________。
① ② ③
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①某温度下,向容积为10L的密闭容器中通入2mol NH3和1molCO2,反应达到平衡时CO2的转化率为50%。该反应的化学平衡常数表达式为K=___________。该温度下平衡常数K的计算结果为____________。
②为进一步提高CO2的平衡转化率,下列措施中能达到目的的是_____________
| A.提高NH3的浓度 | B.增大压强 |
| C.及时转移生成的尿素 | D.使用更高效的催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com