
已知:H+(aq)+OH-(aq)= H2O(l) ΔH="-57.3" kJ/ mol,计算下列中和反应中放出的热量:
(1)用20 g NaOH配成的稀溶液跟足量的稀盐酸反应,能放出 kJ的热量。
(2)用0.1 mol Ba(OH)2配成的稀溶液跟足量的稀硝酸反应,能放出 kJ的热量。
(3)用1 mol醋酸稀溶液和足量NaOH稀溶液反应,放出的热量 (填“大于”、“小于”或“等于”)57.3 kJ,理由是 。
(4)1 L 0.1 mol/L NaOH溶液分别与①醋酸溶液、②浓硫酸、③稀硝酸恰好反应时,放出的热量分别为Q1、Q2、Q3(单位:kJ)。则它们由大至小的顺序为 。
(每空2分,共10分) (1)28.7 (2)11.5
(3)小于 醋酸电离需要吸热 (4)Q2>Q3>Q1
解析试题分析:(1)20g氢氧化钠的物质的量是20g÷40/mol=0.5mol,所以根据中和热的热化学方程式可知,该反应中放出的热量是57.3 kJ/ mol×0.5mol=28.7kJ。
(2)0.1 mol Ba(OH)2配成的稀溶液跟足量的稀硝酸反应生成0.2mol水,则反应中放出的热量是57.3 kJ/ mol×0.2mol=11.5kJ。
(3)醋酸是弱酸,存在电离平衡,而电离是吸热的,所以用1 mol醋酸稀溶液和足量NaOH稀溶液反应,放出的热量小于57.3 kJ。
(4)浓硫酸溶于水放出热量,醋酸溶于水电离吸热,所以1 L 0.1 mol/L NaOH溶液分别与①醋酸溶液、②浓硫酸、③稀硝酸恰好反应时,放出的热量分别为Q1、Q2、Q3(单位:kJ)。则它们由大至小的顺序为Q2>Q3>Q1。
考点:考查中和热的应用、反应热的计算
点评:该题是基础性试题的考查,难度不大。该题的关键是明确反应热、中和热以及热化学方程式的含义,反应热的计算依据。同时还要注意弱电解质的电离平衡特点,有利于培养学生的逻辑思维能力和规范的答题能力。


科目:高中化学 来源: 题型:填空题
已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。回答有关中和反应的问题。
(1)用0.1 mol Ba(OH)2配成稀溶液与足量稀硝酸反应,能放出________kJ热量。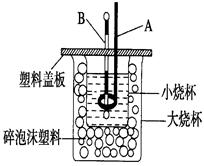
(2)如图装置中仪器A的名称是 ,碎泡沫塑料的作用是 。
(3)若通过实验测定中和热的ΔH,其结果常常大于-57.3 kJ·mol-1,其原因可能是
。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为 。
(2)反应2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(l)+H2O(g)在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。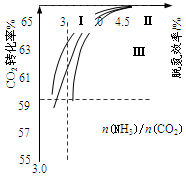
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61
生产中应选用水碳比的数值为 (选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是 。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO2 2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= (空气中氧气的体积含量大约为20%)。
②下图是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为 %。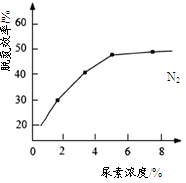
(4)下图表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式 。生产中可分离出的物质A的化学式为 。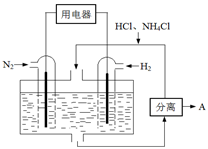
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体直接排入空气中会引起酸雨的有 。
(2)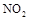 可用尿素
可用尿素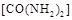 还原(尿素中C元素的化合价为+4价),反应的方程式为:
还原(尿素中C元素的化合价为+4价),反应的方程式为: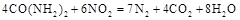 。当消耗掉12g尿素时,转移电子的物质的量是 。
。当消耗掉12g尿素时,转移电子的物质的量是 。
(3)SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的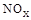 ),改流程中发生的主要反应有:
),改流程中发生的主要反应有: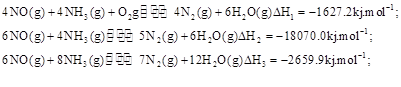
则反应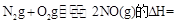 KJ/mol
KJ/mol
(4)CO可用于合成甲醇,反应方程式为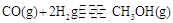 。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
则该反应是 0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为 L。
0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为 L。
(5)工业上用氨水将来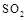 转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为 ;已知25℃时,0.05mol/L(NH4)2SO4溶液的
转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为 ;已知25℃时,0.05mol/L(NH4)2SO4溶液的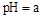 ,则
,则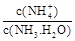 = (用含a的代数式表示,已知
= (用含a的代数式表示,已知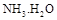 的电离常数
的电离常数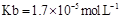 )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮是地球上含量丰富的原子元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)25℃时,0.1mol/LNH4NO3溶液中水的电离程度 (填“大于”、“等于”或“小于”) 0.1mol/L NaOH溶液中水的电离程度。
(2)若将0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合,混合溶液中2c(NH4+)>c(NO3-),所得溶液中离子浓度由大到小的顺序是 。
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。经测定16g气体在上述反应中放出284kJ的热量。则该反应的热化学方程式是 。
(4)下图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图。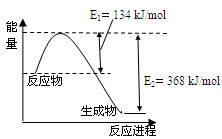
已知:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
2NO (g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
则反应:2NO(g)+2CO(g) N2(g)+2CO2(g)的△H是 。
N2(g)+2CO2(g)的△H是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g) △H1=-574 kJ·mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3

①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为 mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动。
②取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇的反应的△H3 0(填“>”、“<”或“=”)。
(3)脱硫。利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得。NaOH溶液吸收SO2的过程中,pH随n(SO32-)︰n(HSO3﹣)变化关系如下表:
| n(SO32﹣)︰n(HSO3﹣) | 91︰9 | 1︰1 | 9︰91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | N | S | N | Cl- |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
 O2(g) H2O(g) ΔH="-241.8" kJ·mol-1 ①
O2(g) H2O(g) ΔH="-241.8" kJ·mol-1 ① O2(g) CO(g) ΔH="-110.5" kJ·mol-1 ②
O2(g) CO(g) ΔH="-110.5" kJ·mol-1 ② 2NO(g) ΔH>0
2NO(g) ΔH>0查看答案和解析>>
科目:高中化学 来源: 题型:问答题
已知下列热化学方程式:
①C(s)+O2(g)=CO2(g) △H1 =-393.5 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H2 =-566.0 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) △H3 =-571.6 kJ·mol-1
通过计算(要有计算过程),写出1 mol C与液态H2O反应生成CO和H2的热化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: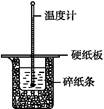
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”)。所求中和热 (填“相等”或“不相等”),简述理由: 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ,用50 mL 0.50 mol·L-1 NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com