
氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。
反应①②③为_________反应(填“吸热”或“放热”)。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为__________________。
① ② ③
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①某温度下,向容积为10L的密闭容器中通入2mol NH3和1molCO2,反应达到平衡时CO2的转化率为50%。该反应的化学平衡常数表达式为K=___________。该温度下平衡常数K的计算结果为____________。
②为进一步提高CO2的平衡转化率,下列措施中能达到目的的是_____________
| A.提高NH3的浓度 | B.增大压强 |
| C.及时转移生成的尿素 | D.使用更高效的催化剂 |
(16分)(1)放热(2分) CH4(g)+H2O(g)=CO(g)+3H2 (g) ΔH=+161.1kJ?mol-1(4分)
(化学方程式书写占2分,未配平不给分,未标注状态得1分;反应热计算占2分,漏“+”且数值正确,得1分)
(2)①K=c(H2O)/[c(CO2) ? c2(NH3)](3分)100 L2?mol-2(3分,未写单位不扣分)
②AB(4分。漏选得2分;多选一个扣2分,扣完4分为止)
解析试题分析:(1)读图可知,①②③的反应物能量都高于生成物能量,所以三个反应都是放热反应;已知:①CO(g)+1/2O2(g)=CO2(g) △H1=-282kJ?mol-1,②1/2O2(g)+ H2(g)=H2O(g) △H2=-241.8kJ?mol-1,③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-846.3kJ?mol-1,观察可知,③—②×3—①能够约去2O2(g)、CO2(g),根据盖斯定律可以得到的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2 (g) ΔH=+161.1kJ?mol-1;(2)①已知可逆反应中氨气、二氧化碳、水都是气体,而尿素是纯液体,纯液体或固体物质不写入化学平衡常数表达式,由平衡常数定义式可得:K=c(H2O)/[ c2(NH3) ?c(CO2)];根据三行浓度法,则:
2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)
CO(NH2)2(l)+H2O(g)
起始浓度/ mol?L-1 0.2 0.1 0
变化浓度/ mol?L-1 0.1 0.05 0.05
平衡浓度/ mol?L-1 0.1 0.05 0.05
K=c(H2O)/[ c2(NH3) ?c(CO2)]=0.05mol?L-1÷(0.1mol?L-1)2÷(0.05mol?L-1)=100L2?mol-2
②提高氨气的浓度,增大一种反应物浓度,平衡右移,则另一种反应物的转化率增大,所以二氧化碳的平衡转化率增大,故A正确;制取尿素是气态物质体积减小的反应,增大压强平衡右移,则反应物的转化率均增大,故B正确;尿素是纯液体,及时转移生成的尿素,不能减小尿素的浓度,则平衡不移动,所以二氧化碳的平衡转化率不变,故C错误;催化剂只能改变反应速率,不能使平衡移动,则反应物的转化率不变,故D错误。
考点:考查反应热、热化学方程式、盖斯定律、化学平衡常数及其计算、外界条件对化学平衡的影响。


科目:高中化学 来源: 题型:填空题
CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体直接排入空气中会引起酸雨的有 。
(2)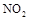 可用尿素
可用尿素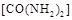 还原(尿素中C元素的化合价为+4价),反应的方程式为:
还原(尿素中C元素的化合价为+4价),反应的方程式为: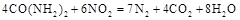 。当消耗掉12g尿素时,转移电子的物质的量是 。
。当消耗掉12g尿素时,转移电子的物质的量是 。
(3)SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的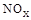 ),改流程中发生的主要反应有:
),改流程中发生的主要反应有: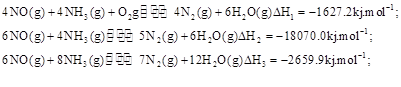
则反应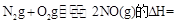 KJ/mol
KJ/mol
(4)CO可用于合成甲醇,反应方程式为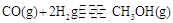 。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
则该反应是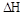 0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为 L。
0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为 L。
(5)工业上用氨水将来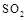 转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为 ;已知25℃时,0.05mol/L(NH4)2SO4溶液的
转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为 ;已知25℃时,0.05mol/L(NH4)2SO4溶液的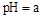 ,则
,则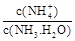 = (用含a的代数式表示,已知
= (用含a的代数式表示,已知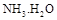 的电离常数
的电离常数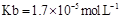 )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
已知下列热化学方程式:
①C(s)+O2(g)=CO2(g) △H1 =-393.5 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H2 =-566.0 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) △H3 =-571.6 kJ·mol-1
通过计算(要有计算过程),写出1 mol C与液态H2O反应生成CO和H2的热化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ?H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ?H = -566.0 kJ/mol
H2O(g)=H2O(1) ?H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池负极反应式为__________________。
③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.lmol·L-1,NaOH溶液中,所得溶液的pH=8,溶液中离子浓度由大到小的顺序是_________________。
(2)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g),ΔH<0若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是____________。
(3)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.l0molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=__________,若继续通入0.20mo1SO2和0.lmolO2,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)在一定条件下,NO2可以被NH3还原为N2来消除NO2对环境造成的污染。25℃时,将NH3溶于水得l00mL 0.lmol·L-的氨水,测得pH=11,则该条件下NH3·H2O的电离平衡常数约为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
I.甲醇是一种优质燃料,可制作燃料电池。工业上可用下列两种反应制备甲醇:
已知:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
2H2(g)+ O2(g)=2H2O(g) ΔH3
则2CO(g)+O2(g)=2CO2(g) 的反应热ΔH=____ ___(用ΔH1、ΔH2、ΔH3表示)。
II.工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量的影响如下图: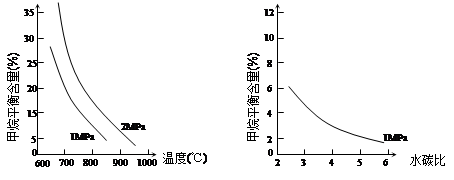
图1(水碳比为3) 图2(800℃)
(1)温度对该反应的反应速率和平衡移动的影响是 。
(2)其他条件不变,请在图2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(3)已知:在700℃,1MPa时,1mol CH4与1mol H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
III.某实验小组设计如图a所示的电池装置,正极的电极反应式为____ ____。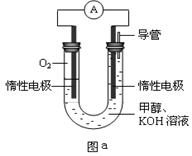
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
甲醇是一种可再生能源,具有开发和应用的广阔前景。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)下列有关上述反应的说法正确的是________。
a.恒温、恒容条件下,容器内的压强不发生变化则可逆反应达到平衡
b.一定条件下,H2的消耗速率是CO的消耗速率的2倍时可逆反应达到平衡
c.保持容器体积不变,升高温度可提高CO的转化率
d.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产量
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。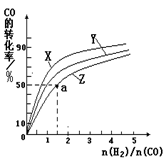
①在上述三种温度中,曲线Z对应的温度是 。
②利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K (写出计算过程)。
③在答题卡相应位置上画出:上述反应达到平衡后,减小体系压强至达到新的平衡过程中,正逆反应速率与时间的变化关系图并标注。
(3)已知:CO(g)+ O2(g)=CO2(g) △H2=-283 kJ·mol-1
O2(g)=CO2(g) △H2=-283 kJ·mol-1
H2(g)+ O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: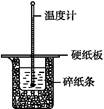
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”)。所求中和热 (填“相等”或“不相等”),简述理由: 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ,用50 mL 0.50 mol·L-1 NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下面关于化学反应的限度的叙述中,正确的是
| A.化学反应的限度都相同 |
| B.可以通过改变温度控制化学反应的限度 |
| C.可以通过延长化学反应的时间改变化学反应的限度 |
| D.当一个化学反应在一定条件下达到限度时,反应即停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:2SO2(g)+O2(g) 2SO3(g)ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是
2SO3(g)ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是
| A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 |
| B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
| C.增大压强或升高温度,该平衡都向逆反应方向移动 |
| D.将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ,此时有2 mol SO2(g)被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com