
ЁОЬтФПЁПБћЯЉЪЧжЦдьвЛДЮадвНгУПкежЕФживЊдСЯЁЃБћЭщДпЛЏЭбЧтЪЧЙЄвЕЩњВњБћЯЉЕФживЊЭООЖЃЌБћЭщДпЭбЧтММЪѕжївЊЗжЮЊбѕЛЏЭбЧтКЭжБНгЭбЧтСНжжЁЃЛиД№ЯТСаЮЪЬтЃК
(1)БћЭщДпЛЏбѕЛЏЭбЧтЗЈжївЊЗДгІШчЯТЃК
2C3H8(g)+O2(g)![]() 2C3H6(g)+2H2O(g) ЁїH1=-236kJЁЄmol-1(i)
2C3H6(g)+2H2O(g) ЁїH1=-236kJЁЄmol-1(i)
ЗДгІЙ§ГЬжаЯћКФЕФC3H8КЭ ЩњГЩЕФC3H6 ЕФЮяжЪЕФСПЫцЮТЖШЕФБфЛЏЙиЯЕМћЯТБэЁЃ
ЗДгІЮТЖШ/Ёц n(ЯћКФ)Лђn(ЩњГЩ)/mol | 535 | 550 | 575 |
C3H8 | 6 | 13 | 33 |
C3H6 | 4 | 8 | 17 |
ЂйЗДгІiжаЗДгІЮяЕФзмФмСП _______ЩњГЩЮяЕФзмФмСП(ЬюЁАДѓгкЁБЁАаЁгкЁБЛђЁАЕШгкЁБ)ЁЃ
ЂкЗжЮіБэжаЪ§ОнЕУЕНБћЯЉЕФбЁдёадЫцЮТЖШЕФЩ§ИпЖј______(ЬюаДЁАВЛБфЁБЁАЩ§ИпЁБЁАНЕ ЕЭЁБ)ЃЛ ГіЯжДЫНсЙћЕФдвђГ§ЩњГЩввЯЉЕШИБВњЮяЭтЛЙПЩФмЪЧ _________ЁЃ(C3H6ЕФбЁдёадЃН![]() ЁС100%)
ЁС100%)
(2)БћЭщДпЛЏжБНгЭбЧтЗДгІЃК C3H8(g) C3H6(g)+ H2(g) ЁїH2=+124. 3kJmol -1 ( ii ) ИБЗДгІЃКC3H8 (g) C2H4 (g) + CH4(g) ЁїH3(iii)

ЂйЗДгІ ii ЕФЦНКтГЃЪ§ЁЂВњЮяБћЯЉбЁдёадЁЂИБВњЮяввЯЉбЁдёадгыЮТЖШЙиЯЕШчЭМЫљЪОЃЌ ЗжЮіЙЄвЕЩњВњжаВЩгУЕФЮТЖШЮЊ 650ЁуC зѓгвЕФдвђЪЧ_________ЁЃ
ЂкЮТЖШЮЊ 670ЁуC ЪБЃЌШєдк 1L ЕФШнЦїжаЭЖШы 8 molC3H8ЃЌГфЗжЗДгІКѓЃЌЦНКтЛьКЯЦјЬхжага 2molCH4КЭвЛЖЈСПC3H8ЁЂC3H6ЁЂH2ЁЂC2H4ЃЌМЦЫуИУЬѕМўЯТC3H6 ЕФбЁдёадЮЊ___ЃЅЁЃ
ЂлгћЪЙБћЯЉЕФВњТЪЬсИпЃЌЯТСаДыЪЉПЩааЕФЪЧ______( ЬюаДађКХ )
a.КубЙЬѕМўЯТЯђдСЯЦјжаВєдгЫЎеєЦј b.діДѓЧтЦјгыБћЭщЕФЭЖСЯБШ c.бЁдёЖдЭбЧтЗДгІИќКУбЁдёадЕФДпЛЏМС d.ДѓбЙЧП
(3)ПЦбЇМвЬНЫїГіРћгУЮоЛњФЄДпЛЏБћЭщЭбЧтжЦБћЯЉЕФаТЙЄвеЃЌИУЙЄвеРћгУЬиЖЈЙІФмФЄНЋЩњГЩЕФЧтЦјДгЗДгІЧјвЛВргабЁдёадЕФМАЪБвЦзпЃЌДгЦНКтНЧЖШЗжЮіИУЙЄвеЕФгХЕу______ЁЃ
ЁОД№АИЁПДѓгк НЕЕЭ Щ§ИпЮТЖШЃЌЗДгІ i ЕФЛЏбЇЦНКтФцЯђвЦЖЏ ЮТЖШПижЦдк 650ЁуC ЃЌБћЯЉбЁдёадИпЃЌЗДгІЫйТЪПьЃЌЦНКтГЃЪ§Дѓ 50 ac НЋЧтЦјМАЪБвЦзпЃЌЛЏбЇЦНКтC3H8(g) C3H6(g)+H2(g)ЃЌе§ЯђвЦЖЏЃЌЬсИпБћЯЉВњТЪ
ЁОНтЮіЁП
(1)ЂйИљОнЮќШШЗДгІКЭЗХШШЗДгІЕФЬиЕуХаЖЯЃЛ
ЂкИљОнЮТЖШЖдЦНКтЕФгАЯьЗжЮіЃЛ
(2) ЂйзлКЯПМТЧбЁдёадЁЂЦНКтГЃЪ§вдМАЗДгІЫйТЪбЁдёКЯЪЪЕФЮТЖШЃЛ
ЂкИљОнЗНГЬЪНЃЌевГіИїзщЗжЕФСПЕФЙиЯЕСаГіЗНГЬЃЌИљОнЦНКтГЃЪ§ЧѓНтЃЛ
ЂлИљОнЦНКтвЦЖЏдРэЗжЮіЃЛ
(3)ИљОнЦНКтвЦЖЏдРэЗжЮіЃЛ
(1)ЂйЗДгІiЕФьЪБфаЁгк0ЃЌЫљвдЮЊЗХШШЗДгІЃЌдђЗДгІЮяЕФзмФмСПДѓгкЩњГЩЮяЕФзмФмСПЃЛ
ЂкИљОнБэИёЪ§ОнПЩжЊИїЮТЖШЯТC3H6ЕФбЁдёадЗжБ№ЮЊ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЃЌ
ЃЌ![]() >
>![]() >
>![]() ЫљвдЫцЮТЖШЩ§ИпБћЯЉЕФбЁдёадНЕЕЭЃЛЗДгІiЮЊЗХШШЗДгІЃЌЩ§ИпЮТЖШЃЌЗДгІ i ЕФЛЏбЇЦНКтФцЯђвЦЖЏЃЌвВЛсЕМжТБћЯЉЕФбЁдёадЯТНЕЃЛ
ЫљвдЫцЮТЖШЩ§ИпБћЯЉЕФбЁдёадНЕЕЭЃЛЗДгІiЮЊЗХШШЗДгІЃЌЩ§ИпЮТЖШЃЌЗДгІ i ЕФЛЏбЇЦНКтФцЯђвЦЖЏЃЌвВЛсЕМжТБћЯЉЕФбЁдёадЯТНЕЃЛ
(2)ЂйОнЭМПЩжЊЃЌЮТЖШПижЦдк 650ЁуC ЃЌБћЯЉбЁдёадИпЃЌЧвДЫЪБЮТЖШНЯИпЃЌЗДгІЫйТЪПьЃЌЖјЧвИУЮТЖШЬѕМўЯТЦНКтГЃЪ§НЯДѓЃЛ
ЂкЦНКтЛьКЯЦјЬхжага 2molCH4ЃЌдђИљОнЗДгІiiiПЩжЊЦНКтЪБИУЗДгІЯћКФЕФn1(C3H8)=2molЃЛЩшЦНКтЪБC3H6ЕФЮяжЪЕФСПЮЊxЃЌИљОнЗДгІiiПЩжЊЦНКтЪБn(H2)=xЃЌЗДгІiiЯћКФЕФn2(C3H8)=xЃЌдђЦНКтЪБШнЦїn(C3H8)=(8-2-x)molЃЌОнЭМПЩжЊИУЮТЖШЯТЗДгІiiЕФlg![]() =0ЃЌЫљвдK=1ЃЌШнЦїЬхЛ§ЮЊ1LЃЌдђга
=0ЃЌЫљвдK=1ЃЌШнЦїЬхЛ§ЮЊ1LЃЌдђга![]() ЃЌНтЕУx=2molЃЌC3H6ЕФбЁдёадЃН
ЃЌНтЕУx=2molЃЌC3H6ЕФбЁдёадЃН![]() ЁС100%=
ЁС100%=![]() =50%ЃЛ
=50%ЃЛ
ЂлaЃЎКубЙЬѕМўЯТЯђдСЯЦјжаВєдгЫЎеєЦјЃЌдђЗДгІЮяКЭЩњГЩЮяЕФЗжбЙМѕаЁЃЌИУЗДгІе§ЗДгІЮЊбЙЧПдіДѓЕФЗДгІЃЌМѕаЁбЙЧПЦНКте§ЯђвЦЖЏЃЌПЩвдЬсИпБћЯЉЕФВњТЪЃЌЙЪaе§ШЗЃЛ
bЃЎЧтЦјЮЊВњЮяЃЌдіДѓЧтЦјЕФСПЛсЪЙЦНКтФцЯђвЦЖЏЃЌБћЯЉЕФВњТЪНЕЕЭЃЌЙЪbДэЮѓЃЛ
cЃЎбЁдёЖдЭбЧтЗДгІИќКУбЁдёадЕФДпЛЏМСЃЌдіДѓБћЯЉЕФбЁдёадЃЌЬсИпВњТЪЃЌЙЪcе§ШЗЃЛ
dЃЎИУЗДгІе§ЗДгІЮЊбЙЧПдіДѓЕФЗДгІЃЌДѓбЙЧПЛсЪЙЦНКтФцЯђвЦЖЏЃЌНЕЕЭВњТЪЃЌЙЪdДэЮѓЃЛ
злЩЯЫљЪібЁacЃЛ
(3)ЧтЦјЗДгІiiЕФВњЮяЃЌНЋЧтЦјМАЪБвЦзпЃЌ C3H8(g) C3H6(g)+H2(g) ЕФЛЏбЇЦНКте§ЯђвЦЖЏЃЌЬсИпБћЯЉВњТЪЃЛ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЮТЖШЯТЗДгІH2(g)ЃЋI2(g)![]() 2HI(g)ЕФЦНКтГЃЪ§KЃН57.0ЃЌЯжЯђДЫЮТЖШЯТЕФецПеШнЦїжаГфШы0.2 molЁЄL1H2(g)ЁЂ0.5molЁЄL1 I2(g)МА0.3molЁЄL1HI(g)ЃЌдђЯТСаЫЕЗЈжае§ШЗЕФЪЧ
2HI(g)ЕФЦНКтГЃЪ§KЃН57.0ЃЌЯжЯђДЫЮТЖШЯТЕФецПеШнЦїжаГфШы0.2 molЁЄL1H2(g)ЁЂ0.5molЁЄL1 I2(g)МА0.3molЁЄL1HI(g)ЃЌдђЯТСаЫЕЗЈжае§ШЗЕФЪЧ
A.ЗДгІе§КУДяЕНЦНКт
B.ЗДгІЯђзѓНјаа
C.ЗДгІЯђФГЗНЯђНјаавЛЖЮЪБМфКѓK<57.0
D.ЗДгІЯђФГЗНЯђНјаавЛЖЮЪБМфКѓc(H2)<0.2molЁЄL1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖдєЧЛљБНМзЫсввѕЅгУгкЪГЦЗЗРИЏМСЃЌЙЄвЕЩЯПЩгУЯТСаЗНЗЈжЦБИЃЌвдЯТЫЕЗЈДэЮѓЕФЪЧ
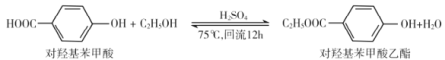
A.ЖдєЧЛљБНМзЫсФмЗЂЩњЫѕОлЗДгІЁЂШЁДњЗДгІB.ПЩгУХЈфхЫЎМьбщВњЮяжаЪЧЗёгаЖдєЧЛљБНМзЫсввѕЅЩњГЩ
C.lmolЖдєЧЛљБНМзЫсввѕЅзюЖргы2molNaOHЗДгІD.ввДМЭбЫЎЩњГЩЕФввЯЉВЛДцдкЫГЗДвьЙЙ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаРЈКХФкЕФЦјЬхЪЧашвЊМьбщЕФдгжЪЃЌМьбщЕФЗНЗЈКЯРэЕФЪЧ(ЁЁЁЁ)
A.H2ЁЂCO2(CO)![]()
![]()
B.H2(CO2ЁЂHCl) ![]()
![]()
C.O2(CO) ![]()
![]()
D.CO(H2OЁЂCO2) ![]()
![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк1200ЁцЪБЃЌЬьШЛЦјЭбСђЙЄвежаЛсЗЂЩњЯТСаЗДгІ
ЂйH2S(g)+![]() O2(g)=SO2(g)+H2O(g) ІЄH1 Ђк2H2S(g)+SO2(g)=
O2(g)=SO2(g)+H2O(g) ІЄH1 Ђк2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ІЄH2
S2(g)+2H2O(g) ІЄH2
ЂлH2S(g)+![]() O2(g)=S(g)+H2O(g) ІЄH3 Ђм2S(g)=S2(g) ІЄH4
O2(g)=S(g)+H2O(g) ІЄH3 Ђм2S(g)=S2(g) ІЄH4
дђІЄH4ЕФе§ШЗБэДяЪНЮЊ
A.ІЄH4=![]() (ІЄH1+ІЄH2-3ІЄH3)B.ІЄH4=
(ІЄH1+ІЄH2-3ІЄH3)B.ІЄH4=![]() (3ІЄH3-ІЄH1-ІЄH2)
(3ІЄH3-ІЄH1-ІЄH2)
C.ІЄH4=![]() (ІЄH1+ІЄH2-3ІЄH3)D.ІЄH4=
(ІЄH1+ІЄH2-3ІЄH3)D.ІЄH4=![]() (ІЄH1-ІЄH2-3ІЄH3)
(ІЄH1-ІЄH2-3ІЄH3)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП450ЁцЪБЃЌдкФГКуШнУмБеШнЦїжаДцдкЗДгІЃКC(s)ЃЋ2NO(g)![]() N2(g)ЃЋCO2(g)ЃЌЯТСаЫЕЗЈФмзї ЮЊХаЖЯИУЗДгІДяЕНЛЏбЇЦНКтзДЬЌБъжОЕФЪЧ
N2(g)ЃЋCO2(g)ЃЌЯТСаЫЕЗЈФмзї ЮЊХаЖЯИУЗДгІДяЕНЛЏбЇЦНКтзДЬЌБъжОЕФЪЧ
A. ШнЦїФкбЙЧПБЃГжВЛБфB. vе§(N2)=2vФц(NO)
C. N2гыCO2ЕФЮяжЪЕФСПжЎБШЮЊ1ЁУ1D. ШнЦїФкЛьКЯЦјЬхЕФУмЖШБЃГжВЛБф
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋ200mlBaCl2ШмвКЕШЗжЮЊСНЗнЃЌвЛЗнжаМгШы100mlЮяжЪЕФСПХЈЖШЮЊ0.1mol/LЕФЯЁСђЫсЃЌЧЁКУЭъШЋГСЕэЃЛСэвЛЗнжаМгШызуСПAgNO3ШмвКЃЌЪЙЦфГфЗжГСЕэЁЃЪдМЦЫуЃК
(1)ДЫBaCl2ШмвКЕФЮяжЪЕФСПХЈЖШЪЧ________
(2)ЩЯЪіЗДгІжаЩњГЩЕФAgClГСЕэЕФжЪСПЪЧ________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІМШЪЧбѕЛЏЛЙдЗДгІЃЌгжЪЧЮќШШЗДгІЕФЪЧ( )
A.ТСЦЌгыЯЁСђЫсЕФЗДгІ
B.Ba(OH)2ЁЄ8H2OгыNH4ClЕФЗДгІ
C.зЦШШЕФЬПгыCO2ЕФЗДгІ
D.МзЭщдкO2жаЕФШМЩеЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПSO2ФмЪЙЫсадKMnO4ШмвКЭЪЩЋЃЌЗДгІЮЊ2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4
ЃЈ1ЃЉгУЫЋЯпЧХЃЈЛђЕЅЯпЧХЃЉБъГіЯТСаЗДгІжаЕчзгзЊвЦЕФЗНЯђКЭЪ§ФПЁЃ___
2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4
ЃЈ2ЃЉИУЗДгІжаЛЙдМСЪЧ___ЃЌЛЙдВњЮяЪЧ___ЁЃ
ЃЈ3ЃЉШєга1molKMnO4ЭъШЋЗДгІЃЌдђзЊвЦЕФЕчзгЕФЮяжЪЕФСПЪЧ___molЃЌВЮМгЗДгІЕФSO2ЦјЬхБъзМзДПіЯТЬхЛ§ЮЊ___LЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com