
【题目】电池有广泛的用途。
Ⅰ.依据氧化还原反应:Cu+2Ag+===Cu2++2Ag设计的原电池如图所示。请回答下列问题:
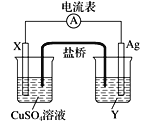
(1)电极X的材料是________________,电解质溶液Y是____________。
(2)银电极的电极反应式是______________________________。
(3)外电路中的电子是从_____极流向_____极。(填“正”或“负”)
(4)该原电池的正极是____________,还可以选用__________________等材料。
Ⅱ.铅蓄电池是化学电源,它工作时的电池总反应为:PbO2+Pb+2H2SO4===2PbSO4+2H2O。试回答:
(5)蓄电池负极的电极材料是_____________________(填“PbO2”或“Pb”)。
(6)工作时该蓄电池正极的电极反应式是___________。
(7)铅蓄电池工作时,电解质溶液的密度________(填“增大”、“减小”或“不变”),负极质量____ (填“增大”、“减小”或“不变”)。
Ⅲ.某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。
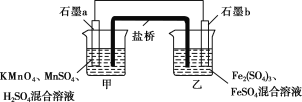
回答下列问题:
(8)此原电池的正极是石墨________(填“a”或“b”),发生________反应。
(9)电池工作时,盐桥中的SO![]() 移向________(填“甲”或“乙”)烧杯。
移向________(填“甲”或“乙”)烧杯。
(10)甲烧杯中的电极反应式为________________________________。
(11)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为________mol。
【答案】铜 硝酸银溶液 Ag++e-===Ag 负(或铜) 正(或银) 银 铂、石墨等合理即可 Pb PbO2+4H++SO42—+2e-=PbSO4+2H2O 减小 增大 a 还原 乙 MnO4—+8H++5e-===Mn2++4H2O 0.5
【解析】
Ⅰ.由反应方程式可知,该原电池的电极反应式为:正极:2Ag++2e-═2Ag,负极:Cu-2e-═Cu2+,所以X极的材料应为Cu,电解质溶液Y应为AgNO3溶液,外电路中的电子从Cu极流向Ag极.盐桥中的K+移向正极(Ag极);NO3-移向负极(Cu极);
Ⅱ.(5)铅蓄电池放电时,正极上得电子发生还原反应,根据反应类型确定正极;
(6)铅蓄电池放电时,负极上失电子发生氧化反应;
(7)电解时硫酸参加反应且生成水,根据电解质溶液的浓度变化判断溶液密度及负极质量的变化;
Ⅲ.(8)反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,KMnO4作氧化剂,发生还原反应;
(9)电池工作时,阴离子向负极移动;
(10)甲烧杯中的电极发生还原反应;乙烧杯中的电极发生氧化反应;
(11)溶液中的MnSO4浓度由1mol·L-1变为1.5mol·L-1,计算物质的量,结合化合价的变化可计算转移电子的物质的量。
(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3溶液,故答案为:Cu;硝酸银溶液。
(2)正极为活泼性较弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,故答案为:Ag++e-=Ag。
(3)原电池中,电子从负极经外电路流向正极,本题中由Cu极经外电路流向Ag极,故答案为:负(或铜),正(或银)。
(4)该原电池的正极为活泼性较弱的Ag,Ag电极作正极可以被铂、石墨等代替,故答案为:银;铂、石墨等。
(5)铅蓄电池中,根据原电池反应式中元素化合价变化知,Pb中Pb元素化合价由0价变为+2价,所以Pb作负极,故答案为:Pb。
(6)工作时,该铅蓄电池正极上PbO2得电子发生还原反应,电极反应为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,故答案为:PbO2+SO42-+2e-+4H+═PbSO4+2H2O。
(7)铅蓄电池工作时,硫酸参加反应生成硫酸铅同时生成水,导致硫酸浓度降低、密度减小,该铅蓄电池负极上Pb失电子发生氧化反应,电极反应为:Pb+SO42--2e-═PbSO4,所以负极质量增大,故答案为:减小;增大。
(8)根据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应,故石墨a是正极,故答案为:a;还原。
(9)电池工作时,SO42-向负极移动,即向乙烧杯移动,故答案为:乙。
(10)甲烧杯中的电极反应式为MnO4-+5e-+8H+═Mn2++4H2O;故答案为:MnO4-+5e-+8H+═Mn2++4H2O。
(11)溶液中的MnSO4浓度由1mol·L-1变为1.5mol·L-1,由于溶液的体积未变,则反应过程中生成的MnSO4的物质的量为0.5mol·L-1×0.2L=0.1mol,转移的电子为0.1mol×5=0.5mol。故答案为:0.5。


科目:高中化学 来源: 题型:
【题目】25℃时,在25 mL 0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析正确的是( )
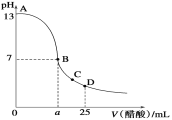
A. 该滴定过程应该选择甲基橙作为指示剂
B. B点的横坐标a=12.5
C. 水的电离程度:D > C > B
D. D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电池的说法不正确的是( )
A. 手机上用的锂离子电池属于二次电池
B. 锌锰干电池中,锌电极是负极
C. 氢氧燃料电池可把化学能转化为电能
D. 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物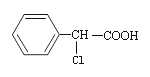 有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )
有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )
A. 6种 B. 9种 C. 15种 D. 19种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 大理石与醋酸反应:CO32-+2CH3COOH![]() 2CH3COOˉ+H2O+CO2↑
2CH3COOˉ+H2O+CO2↑
B. 高锰酸钾与浓盐酸制氯气的反应:MnO4-+4Clˉ+8H+![]() Mn2++2Cl2↑+4H2O
Mn2++2Cl2↑+4H2O
C. 漂白粉溶液吸收少量二氧化硫气体:SO2+H2O+ClOˉ![]() SO42-+Clˉ+2H+
SO42-+Clˉ+2H+
D. 氢氧化钠溶液与过量的碳酸氢钙溶液反应:OHˉ+Ca2++HCO3-![]() CaCO3↓+H2O
CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学–选修3:物质结构与性质)碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(1)在第二周期的元素中,第一电离能介于B与N之间的元素有_________种。
(2)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是_____________。
(3)Fe与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为______________。请写出一个与CO互为等电子体的离子:________________。

(4)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Gr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH氧化成CH3COOH,试写出基态铬原子的价层电子排布式__________;CH3COOH分子中碳原子的杂化类型为___________。
②该配离子[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为_______,NH3的VSEPR模型为_______。
③铜铬合金的晶胞如图所示,已知晶胞中Cr和Cu原子间的最近距离为![]() apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com