
【题目】关于离子化合物NH5,下列说法正确的是
A.N为-5价B.阳离子的电子数为11
C.阴离子为8电子稳定结构D.阴阳离子个数比是1:1
科目:高中化学 来源: 题型:
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO |
阳离子 | Al3+、Fe3+、Mg2+、NH、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
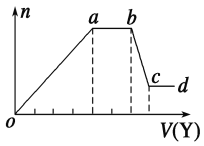
(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是___,ab段发生反应的离子是______________,bc段发生反应的离子方程式为______________。
(2)若Y是NaOH溶液,则X中一定含有的离子是___________________。ab段反应的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
(2)反应①达平衡后采取下列措施,能提高CH3OH产率的有__________。
A.加入H2 B.升高温度 C.增大压强 D.使用催化剂
(3)在一定温度下,将4mol CO和4mol H2混合置于2L的密闭容器中发生反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),60s时达到平衡状态时,测得气体的总物质的量为4mol。达平衡时,氢气的转化率为__________,用CO表示的反应速率为__________,该反应的平衡常数为__________。
CH3OCH3(g)+CO2(g),60s时达到平衡状态时,测得气体的总物质的量为4mol。达平衡时,氢气的转化率为__________,用CO表示的反应速率为__________,该反应的平衡常数为__________。
(4)以下说法能说明反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)达到平衡状态的有__________。
CH3OCH3(g)+CO2(g)达到平衡状态的有__________。
A. 氢气和二氧化碳的浓度之比为3∶1
B.单位时间内断裂3个H-H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(5)二甲醚燃料电池的工作原理如图所示:
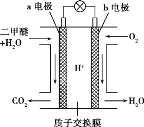
该电池负极的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是取样,先滴加_______溶液,再滴加________,该过程的现象为_____________________。
(2)步骤②加入过量H2O2所发生的离子方程式是________________,体现了H2O2的_______(填“氧化”或“还原”)性。
(3)步骤③反应中可加入________溶液。
(4)步骤④反应的化学方程式_____________________。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池有广泛的用途。
Ⅰ.依据氧化还原反应:Cu+2Ag+===Cu2++2Ag设计的原电池如图所示。请回答下列问题:
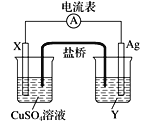
(1)电极X的材料是________________,电解质溶液Y是____________。
(2)银电极的电极反应式是______________________________。
(3)外电路中的电子是从_____极流向_____极。(填“正”或“负”)
(4)该原电池的正极是____________,还可以选用__________________等材料。
Ⅱ.铅蓄电池是化学电源,它工作时的电池总反应为:PbO2+Pb+2H2SO4===2PbSO4+2H2O。试回答:
(5)蓄电池负极的电极材料是_____________________(填“PbO2”或“Pb”)。
(6)工作时该蓄电池正极的电极反应式是___________。
(7)铅蓄电池工作时,电解质溶液的密度________(填“增大”、“减小”或“不变”),负极质量____ (填“增大”、“减小”或“不变”)。
Ⅲ.某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。
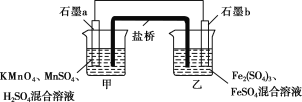
回答下列问题:
(8)此原电池的正极是石墨________(填“a”或“b”),发生________反应。
(9)电池工作时,盐桥中的SO![]() 移向________(填“甲”或“乙”)烧杯。
移向________(填“甲”或“乙”)烧杯。
(10)甲烧杯中的电极反应式为________________________________。
(11)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用反应Cr2O7n-+CH3OH+H+→Cr3++CO2↑+H2O(未配平)来测定工业甲醇中甲醇的含量,下列说法中正确的是( )
A. 溶液的颜色从灰绿色变为橙色
B. Cr2O7n-发生氧化反应
C. 若配平后Cr3+和CO2的化学计量数比为2:1,则Cr2O7n-中的n=2
D. 若有3.2 g CH3OH参加反应,则转移的电子数为6.02×1022
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com