
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是取样,先滴加_______溶液,再滴加________,该过程的现象为_____________________。
(2)步骤②加入过量H2O2所发生的离子方程式是________________,体现了H2O2的_______(填“氧化”或“还原”)性。
(3)步骤③反应中可加入________溶液。
(4)步骤④反应的化学方程式_____________________。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为________g。
【答案】KSCN溶液新制氯水先无明显现象,后溶液出现血红色2Fe2++2H++H2O2=2Fe3++2H2O氧化NaOH溶液2Fe(OH)3=Fe2O3+3H2O7a/100
【解析】
由流程图可以知道,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量。
由流程图可以知道,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量。
(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在;本题可以加入氧化剂将Fe2+氧化为Fe3+再进行检验:先滴加KSCN溶液,溶液不变色,加入氯水,发生:2Fe2++Cl2=2Fe3++2 Cl-,溶液变为血红色,发生Fe3++3SCN-Fe(SCN)3,说明含有Fe2+;因此,本题正确答案是:KSCN溶液;新制氯水;先无明显现象,后溶液出现血红色。
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,反应离子方程式:2 Fe2++2H++H2O2=2Fe3++2H2O; 综上所述,本题答案是:2Fe2++2H++H2O2=2Fe3++2H2O,氧化。
(3)亚铁离子被双氧水氧化为铁离子,为生成氢氧化铁红褐色沉淀,可以加入氢氧化钠溶液;综上所述,本题答案是: NaOH溶液。
(4)步骤④中反应为氢氧化铁分解生成氧化铁和水,反应的化学方程式为:2Fe(OH)3=Fe2O3+3H2O;综上所述,本题答案是:2Fe(OH)3=Fe2O3+3H2O。
(5)根据铁元素守恒:2Fe—Fe2O3可知,氧化铁的质量为ag,其物质的量为a/160mol,则 n(Fe)=2×a/160= a/80 mol,则每片补血剂中含铁元素的质量为[56×a/80]×1/10=7a/100 g;综上所述,本题答案是:7a/100。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】![]() 是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
A. ![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B. ![]() 原子核外有143个电子
原子核外有143个电子
C. ![]() 与
与![]() 互为同位素 D.
互为同位素 D. ![]() 与
与![]() 为同一核素
为同一核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X、Y、Z三种元素,已知有如下情况:
①X、Y、Z的单质在常温下均为气体。
② X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
③ XZ极易溶于水,在水溶液中电离出X+和Z-。XZ的水溶液可使石蕊试液变红。
④ 两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体。
⑤ Z的单质溶于X2Y中,所得溶液具有漂白作用。
请完成下列问题:
(1)写出XZ和X2Y的化学式:XZ_____ X2Y______
(2)Z的单质溶于X2Y后,溶液起漂白作用的物质是______(写化学式)。
(3)写出X的单质在Z的单质中燃烧的化学方程式_____________。
(4)Z的单质与氢氧化钠溶液发生反应的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构简式如图: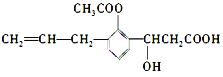 。则此有机物可发生的反应类型有 ( )
。则此有机物可发生的反应类型有 ( )
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦中和 ⑧加聚
A. ①②③⑤⑥ B. ②③④⑤⑥⑧ C. ②③④⑤⑥⑦ D. ①②③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示的原电池,下列说法正确的是( )
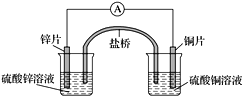
A. 电子从锌电极通过电流表流向铜电极
B. 盐桥中的阴离子向硫酸铜溶液中迁移
C. 铜电极发生还原反应,其电极反应是2H++2e-===H2↑
D. 取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物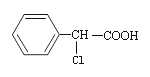 有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )
有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )
A. 6种 B. 9种 C. 15种 D. 19种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是K的合成路线。

(1)按官能团分类,A的类别是__________。
(2)A→B的化学方程式是____________________。
(3)C→D所需的试剂a是__________。
(4)检验F存在的试剂及现象是__________。
(5)F→G的反应类型是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
【制备FeBr2固体】
实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时,先将干燥、纯净的CO2气流通入D中,再将铁粉加热至600—700℃,E管中铁粉开始反应。不断将d中液溴滴入温度为100—120℃的D中,经过一段时间的连续反应,在不锈钢管内产生黄绿色鳞片状溴化亚铁。

(1)若在A中盛固体CaCO3,a中盛有6 mol/L的盐酸。为使导入D中的CO2为干燥纯净的气体,则图中B、C处的洗气瓶中装有的试剂分别是:B中为____________,C中为_________________。
若进入E装置中的CO2未干燥,则可能发生的副反应的化学方程式为_____________________。
(2)E管中的反应开始前通入CO2的主要作用是__________________________________;
E管中的反应开后持续通入CO2的主要作用是______________________________________。
【探究FeBr2的还原性】
(3)现实验需要90 mL 0.1 mol/L FeBr2溶液,取上述反应制得的FeBr2固体配制该溶液,所需仪器除烧杯、量筒、玻璃棒外,还需要的玻璃仪器是_______________________________。
(4)已知:Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色。Cl2既能氧化Br-,也能氧化Fe2+。
取10 mL上述FeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为血红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。
以上实验结论表明还原性:Fe2+__________Br-(填“>”或“<”)。
(5)若在40 mL上述FeBr2溶液中通入标准状况下67.2 mL的 C12,取少量反应后的溶液加入CCl4,振荡后下层液体呈______色,写出该反应的离子方程式________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com