
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)![]() C(g)+D(g),下列描述中不能表明该反应已达到平衡状态的是
C(g)+D(g),下列描述中不能表明该反应已达到平衡状态的是
A.混合气体的密度不变B.单位时间内生成nmolD,同时生成nmolC
C.容器中的温度不再变化D.C(g)的物质的量浓度不变
【答案】B
【解析】
A. 反应物中有固体,在反应过程中固体转化为气体,气体的质量变大,而容器的体积不变,故混合气体的密度是变量,当混合气体的密度不变时,表明各组分的浓度保持不变,故A能表明该反应已达到平衡状态;
B. 单位时间内生成nmolD,同时生成nmolC,只说明了正反应速率,不能说明正反应速率等于逆反应速率,故B不能表明该反应已达到平衡状态;
C. 化学反应一定会伴随着能量变化,由于该容器为绝热的,故在反应过程中容器内的温度会有变化,当容器中的温度不再变化时,说明正反应速率等于逆反应速率,故C能表明该反应已达到平衡状态;
D. C(g)的物质的量浓度不变,说明正反应速率等于逆反应速率,故D能表明该反应已达到平衡状态。
综上所述,不能表明该反应已达到平衡状态的是B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
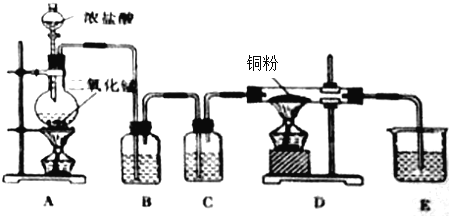
【题目】(一)用![]() 和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水
和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水![]() ,装置如下图所示。
,装置如下图所示。
![]()
回答下列问题:
(1)写出在A中发生反应的化学方程式为:_______________________________________________
(2)B中选用的试剂是______________,其作用是________________________;C中选用的试剂是______________,其作用是________________________;E中选用的试剂是_____________,其作用是________________________;
(3)D中反应的化学方程式是________________________________________________
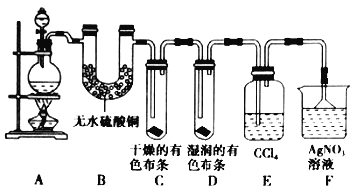
(二)某校化学实验兴趣小组为了探究在实验室制备![]() 的过程中有水蒸气和
的过程中有水蒸气和![]() 挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
(4)若用含有![]() 的浓盐酸与足量的
的浓盐酸与足量的![]() 反应制
反应制![]() ,制得的
,制得的![]() 体积(标准状况下)总是小于
体积(标准状况下)总是小于![]() 的原因是____________________________________________________。
的原因是____________________________________________________。
(5)①装置B的作用是_______________________________________________,现象是_______________________________________________。
②装置C和D出现的不同现象说明的问题是_______________________________________________。
③装置E的作用是_______________________________________________。
(6)乙同学认为甲同学的实验有缺陷,不能确保最终通入![]() 溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入
溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入![]() 溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在_________与_________之间(填装置字母序号),装置中应放入____________________________________________。
溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在_________与_________之间(填装置字母序号),装置中应放入____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富镍三元层状氧化物LiNi0.8Co0.1Mn0.1O2(NCM811)作为下一代锂离子电池的正极材被广泛关注和深入研究,纳米级TiO2形成的表面包覆对提高该材料的性能效果明显。回答下列问题:
(1)Li在元素周期表中的位置为___;基态Ni的电子排布式为___,基态Co3+有__个未成对电子。
(2)制备NCM811的过程中,残余的Li2CO3会破坏材料的界面,CO32-的空间构型是___,其中C原子的杂化方式为___。
(3)该电池初始充电过程中,会有C2H4等气体产生。C2H4分子中。![]() 键和
键和![]() 键数目之比为__。
键数目之比为__。
(4)TiO2的晶胞(![]() =
=![]() =
=![]() =90o)如图所示:
=90o)如图所示:
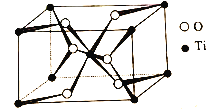
TiO2晶体中O原子的配位数是__,其晶胞参数为:a=b=459pm,c=295pm,该晶体的密度为__g/cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
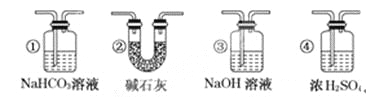
【题目】某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性,回答下列问题。
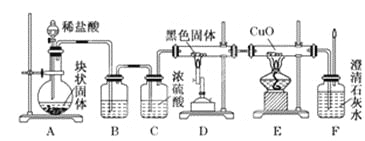
(1)写出装置A中所发生反应的离子方程式___________。
(2) B中最适宜的试剂是___________。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:_________。
(4)装置D中黑色固体为________(填名称),反应的化学方程式为________________。
(5)按照如图装置进行实验时,首先进行的操作是_______________________。
(6)根据实验中的_________现象,可证明CO具有还原性,有关反应的化学方程式是________。
(7)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置___与_____之间连接下图中的________装置(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
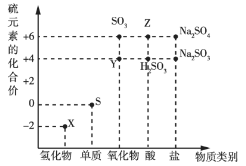
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有______(填化学式)。
(2)将![]() 与
与![]() 混合,可生成黄色固体,该反应中氧化剂与还原剂的物质的量之比为______。
混合,可生成黄色固体,该反应中氧化剂与还原剂的物质的量之比为______。
(3)![]() 是重要的化工原料。从氧化还原反应的角度分析,下列制备
是重要的化工原料。从氧化还原反应的角度分析,下列制备![]() 的方案理论上可行的是______(填序号)。
的方案理论上可行的是______(填序号)。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(4)已知![]() 能被
能被![]() 氧化为
氧化为![]() ,则
,则![]() 的
的![]() 溶液与
溶液与![]() 的
的![]() 溶液恰好反应时,
溶液恰好反应时,![]() 元素在还原产物中的化合价为______。
元素在还原产物中的化合价为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示由元素周期表中1到20号且不同主族的元素组成的单质及化合物之间的转化关系(产物中的水已略去)。其中A为黄绿色气体单质,D有漂白性;在实验室中常用固体B和固体C加热制取刺激性气味F;F和G的组成元素相同,G与H分子所含电子数相同。
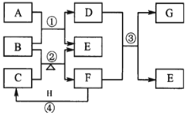
请回答
(1)单质A的组成元素在周期表中的位置是________;
(2)B的化学式为________,F的电子式为________,C中所含化学键类型有_______;
(3)写出反应②的化学方程式_____________;
(4)反应④中F和气体H在空气中相遇时的实验现象为__________写出的F一种具体用途_______________;
(5)向具有漂白作用的D溶液中加入H的浓溶液有A生成,其反应的离子方程式为______________。
(6)砷元素(As)与上述某元素处于同一主族。砷酸铅可用作杀虫剂。已知:
①在砷酸铅中,砷处于最高价态,铅处于稳定价态。
②砷酸铅是正砷酸对应的盐,1mol正砷酸分子中含有8mol原子.
砷的最高价氧化物的化学式为___________砷酸铅的化学式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是 ( )
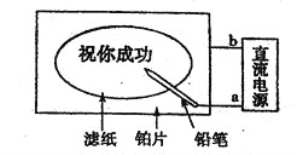
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.a点是负极,b点是正极
D.铅笔端有少量的氯气产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com