
| A、该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe |
| B、Li-Al合金在电池中作为负极材料 |
| C、负极的电极反应式为Al-3e-=Al3+ |
| D、充电时,阳极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS |


科目:高中化学 来源: 题型:

| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | |
| 乙 | H2O | 丙 | |||
| 1 | 650 | 4 | 2 | 1.6 | 5 |
| 2 | 900 | 2 | 1 | 0.4 | 3 |
| 3 | 900 | 2 | 1 | 0.4 | 1 |
| 物质 | 乙 | H2O | 丙 | H2 |
| 起始量/mol | 0.8 | 1.0 | 0.6 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④⑤ | B、①④ | C、②③ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| X Y Z |
0.1g | 0.3g | 0.5g |
| 1.5% | 223g | 67s | 56s |
| 3.0% | 308s | 109s | 98s |
| 4.5% | 395s | 149s | 116s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强酸溶液产生的H2多 |
| B、弱酸溶液产生的H2多 |
| C、两者产生的H2一样多 |
| D、无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
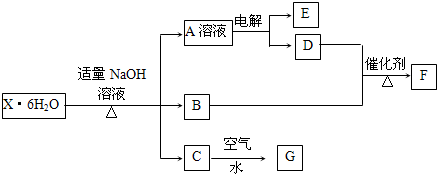
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、常温时,在c(H+)=
| ||
| B、含大量Fe2+的溶液:Na+、Mg2+、H+、NO3- | ||
| C、含有大量Al3+的溶液:K+、Na+、AlO2-、SO42- | ||
| D、在c(H+)/c(OH-)=1×1013的溶液:NH4+、Mg2+、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Al3+)=0.1mol/L的溶液中:Na+、K+、AlO-2、OH- |
| B、无色溶液中:K+、CH3COO-、HCO-3、MnO4- |
| C、c(H+)/c(OH-)=1×1014的溶液:Ba2+、Na+、SO32-、NO-3 |
| D、通入足量CO2后所含离子还能大量共存的是:K+、Ca2+、NO-3、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com