

| X Y Z |
0.1g | 0.3g | 0.5g |
| 1.5% | 223g | 67s | 56s |
| 3.0% | 308s | 109s | 98s |
| 4.5% | 395s | 149s | 116s |
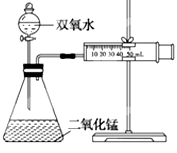
 ;
;| △c |
| △t |
| △c |
| △t |


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:
| A、乙烯的结构简式:C2H4 | ||
B、中子数为20的钾原子:
| ||
C、次氯酸的电子式: | ||
D、CH4分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:
 根据如图可以写出热化学方程式As2O5(s)=As2O3(s)+O2( g)△H=a kJ/mol.则a为( )
根据如图可以写出热化学方程式As2O5(s)=As2O3(s)+O2( g)△H=a kJ/mol.则a为( )| A、+1533.8 |
| B、-1533.8 |
| C、+295.4 |
| D、-295.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在澄清石灰水中通入过量CO2:CO2+2OH-=CO32-+H2O | ||||
B、用惰性电极电解Cu(NO3)2溶液:Cu2++2OH-
| ||||
| C、将足量Cl2通入到FeI2溶液中:3Cl2+2Fe2++4I-=2I2+6Cl-+2Fe3+ | ||||
| D、金属Al溶于氢氧化钠溶液中:Al+2OH-=AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
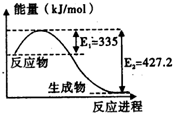 (1)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
(1)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定条件下,Cu2+、Mn2+、Fe3+的浓度对乙酸在光照下催化降解速率的影响如图所示.下列判断不正确的是( )
一定条件下,Cu2+、Mn2+、Fe3+的浓度对乙酸在光照下催化降解速率的影响如图所示.下列判断不正确的是( )| A、Cu2+、Mn2+提高乙酸降解速率的最佳浓度为0.1 mol?L-l |
| B、Fe3+不能提高乙酸降解速率 |
| C、相同条件下,乙酸在Cu2+、Mn2+、Fe3+作用下的降解速率依次减小 |
| D、该实验方案的缺陷之一是未做空白对照实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe |
| B、Li-Al合金在电池中作为负极材料 |
| C、负极的电极反应式为Al-3e-=Al3+ |
| D、充电时,阳极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0L1.0mol?L-1CH3COOH溶液中,CH3COOH分子数为NA |
| B、1 molNa2O2与足量H2O反应转移的电子数NA |
| C、常温常压下,22.4L的D2、H2组成的气体分子数约为NA |
| D、4.6g NO2和N2O4的混合物所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com