
【题目】某化学实验小组用酸性KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
I | 向一支试管中先加入1 mL 0.01 mol/L酸性 KMnO4溶液,再加入1滴3 mol/L硫酸和9滴蒸馏水,最后加入1 mL 0.1 mol/L草酸溶液 | 前10 min内溶液紫色无明显变化,后颜色逐渐变浅, 30 min后几乎变为无色 |
II | 向另一支试管中先加入1 mL 0.01 mol/L酸性 KMnO4溶液,再加入10滴3 mol/L硫酸,最后加入1 mL 0.1 mol/L草酸溶液 | 80 s内溶液紫色无明显变化,后颜色迅速变浅,约150 s后几乎变为无色 |
(1)补全高锰酸钾与草酸反应的离子方程式:5H2C2O4 + 2MnO4- + 6H+ === 2Mn2+ + ______ +______
(2)由实验I、II可得出的结论是______。
(3)关于实验II中80 s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01 mol/L酸性 KMnO4溶液,0.1 mol/L草酸溶液,3 mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
① 补全实验III的操作:向试管中先加入1 mL 0.01 mol/L酸性 KMnO4溶液,______,最后加入1 mL 0.1 mol/L草酸溶液。
② 若猜想成立,应观察到的实验现象是______。
(4)该小组拟采用如下图所示的实验方案继续探究外界条件对反应速率的影响。
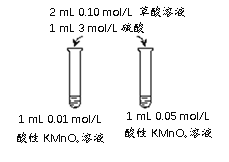
① 他们拟研究的影响因素是______。
② 你认为他们的实验方案______(填“合理”或“不合理”),理由是______。
【答案】10CO2 8H2O 其他条件相同时,H+(或硫酸)浓度越大,反应速率越快 再加入10滴3 mol/L硫酸,然后加入少量MnSO4固体 加入草酸溶液后,溶液紫色迅速变浅(或溶液颜色开始变浅的时间小于80 s,或其他合理答案) KMnO4溶液浓度 不合理 KMnO4溶液浓度不同,溶液起始颜色深浅不同,无法通过比较褪色时间长短判断反应快慢
【解析】
(1)在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,据此写出离子方程式;
(2)实验I、II取用的高锰酸钾和草酸的体积与浓度均相同,加入的硫酸的滴数不同;
(3)①根据实验目的“反应中生成的Mn2+对反应有催化作用”,完成实验步骤;②若猜想成立,反应速率应该加快;
(4)①根据实验步骤示意图,取用的草酸和硫酸相同,选用的高锰酸钾的浓度不同;②KMnO4溶液浓度不同,溶液起始颜色深浅不同,据此分析判断。
(1)在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为:10CO2↑;8H2O;
(2)实验I、II取用的高锰酸钾和草酸的体积与浓度均相同,不同的是加入的硫酸的滴数不同,使得溶液褪色需要的时间不同,因此实验结论为:其他条件相同时,H+(或硫酸)浓度越大,反应速率越快,故答案为:其他条件相同时,H+(或硫酸)浓度越大,反应速率越快;
(3)①要证明反应中生成的Mn2+对反应有催化作用,结合实验III的操作可知:向试管中先加入1 mL 0.01 mol/L酸性 KMnO4溶液,再加入10滴3 mol/L硫酸,然后加入少量MnSO4固体,最后加入1 mL 0.1 mol/L草酸溶液,通过观察溶液褪色的时间即可证明,故答案为:再加入10滴3 mol/L硫酸,然后加入少量MnSO4固体;
②若猜想成立,加入草酸溶液后,溶液紫色迅速变浅(或溶液颜色开始变浅的时间小于80 s),故答案为:加入草酸溶液后,溶液紫色迅速变浅(或溶液颜色开始变浅的时间小于80 s);
(4)①根据实验步骤示意图,取用的草酸和硫酸相同,不同的是选用的高锰酸钾的浓度不同,因此实验研究的影响因素是KMnO4溶液浓度对反应速率的影响,故答案为:KMnO4溶液浓度;
②该实验方案不合理,因为KMnO4溶液浓度不同,溶液起始颜色深浅不同,无法通过比较褪色时间长短判断反应快慢,故答案为:不合理;KMnO4溶液浓度不同,溶液起始颜色深浅不同,无法通过比较褪色时间长短判断反应快慢。


科目:高中化学 来源: 题型:
【题目】硼酸( H3BO3) 为一元弱酸,H3BO3可以通过电解的方法制备。其工作原理如右图所示( 阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是
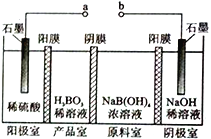
A. a 与电源的正极相连接
B. 阳极的电极反应式为:2H2O-4e-=O2↑+4H+
C. [B(OH)4]-穿过阴膜进入产品室,Na+穿过阳膜进入阴极室
D. 当电路中通过3mol 电子时,可得到1molH3BO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在2 L密闭容器中发生反应:A(g)+3B(g) === 2C(g) + 4D(g),测得5 min内,A的物质的量减小了10 mol,则5 min内该反应的化学反应速率是
A. υ(A) = 1 mol/(L·min)
B. υ(B) = 1 mol/(L·min)
C. υ(C) = 1 mol/(L·min)
D. υ(D) = 1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是在载人航天器舱内利用氢氧燃料电池进行二氧化碳浓缩富集的装置。下列说法正确的是
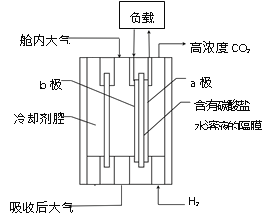
A. a极为电池的正极
B. b极的电极反应:2CO2 + O2 + 4e- === 2CO32-
C. 该装置工作时电能转化成了化学能
D. CO32- 向b极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反-2-己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一。根据该合成路线回答下列问题:
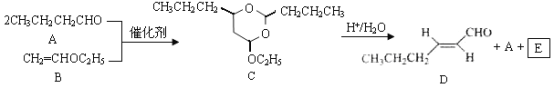
已知: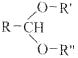
![]() RCHO+R'OH+R"OH
RCHO+R'OH+R"OH
(1)A的名称是__________;B分子中共面原子数目最多为__________;C分子中与环相连的三个基团中,不同化学环境的氢原子共有__________种。
(2)D中含氧官能团的名称是__________,写出检验该官能团的化学反应方程式:__________。
(3)E为有机物,能发生的反应有__________。
a.聚合反应b.加成反应c.消去反应d.取代反应
(4)B的同分异构体F与B有完全相同的官能团,写出F所有可能的结构:________。
(5)以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整。
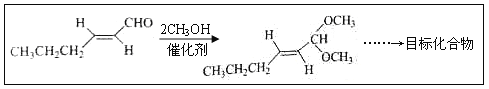
(6)问题(5)的合成路线中第一步反应的目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某医药中间体F的制备流程如图(部分产物已略去)。
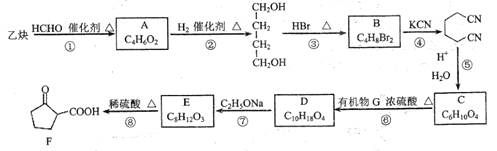
已知: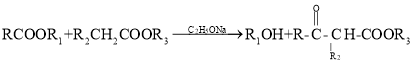 (
(![]() 表示烃基)
表示烃基)
(1)F中含有官能团的名称是羧基和_______。
(2)实验室制取乙炔的化学方程式为____________。
(3)A不能发生银镜反应,则A的结构简式为_________。
(4)反应①~④中,属于加成反应的是___________(填序号)。
(5)反应⑥的化学方程式为________。
(6)E的结构简式为________。
(7)某聚合物![]() 的单体与
的单体与![]() 互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为
互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为![]() ,且能与
,且能与![]() 溶液反应,则聚合物
溶液反应,则聚合物![]() 的结构简式是_______。
的结构简式是_______。
(8)已知:i. ![]() +
+![]()
![]()

ii.RCH=CHR′![]() RCHO+R′CHO(R,R′表示烃基)
RCHO+R′CHO(R,R′表示烃基)
以![]() 和
和![]() 为起始原料合成
为起始原料合成![]() ,选用必要的无机试剂,写出合成路线流程图: _______________。合成路流程图例:
,选用必要的无机试剂,写出合成路线流程图: _______________。合成路流程图例:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期中8种元素a-h,其原子半径、最高正化合价或最低负化合价随原子序数递增的变化如图所示。
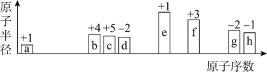
下列判断不正确的是
A.a、d、f组成的化合物能溶于强碱溶液
B.a可分别与b或c组成含10个电子的分子
C.e的阳离子与g的阴离子具有相同的电子层结构
D.最高价氧化物对应水化物的酸性:h>g>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】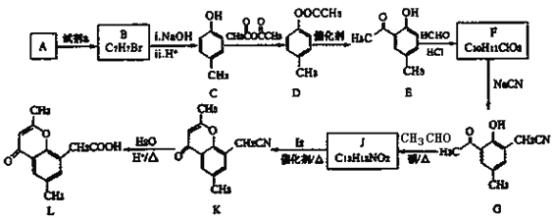
已知:①R-X![]() R-CN
R-CN![]() R-COOH
R-COOH
②R1CHO+CH3COR2![]() R1CH=CHCOR2
R1CH=CHCOR2
③![]()
(1)A 的分子式是 C7H8,写出 A→B 反应的化学方程式_____。
(2)写出 C→D 的化学方程式_____。
(3)E 与 HCHO 反应的反应类型为_____,写出 F 的结构简式_____。
(4)写出 D 与足量 NaOH 溶液反应的化学方程式____________。
(5)写出 J 与 I2 反应生成 K 和 HI 的化学方程式____________________。
(6)以 A 和乙烯为起始原料,结合题中信息,选用必要的无机试剂合成苯乙酸乙酯(![]() ),写出相应的合成路线_____________。
),写出相应的合成路线_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com