
【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大
科目:高中化学 来源: 题型:
【题目】实验室用下列两种方法制取氯气:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87g MnO2与足量的浓盐酸反应,则所得Cl2质量
A. ①比②多B. ②比①多C. 一样多D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
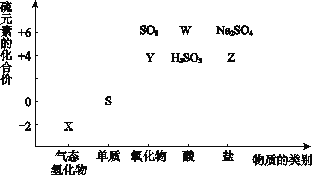
(1)Y的化学式为_________,检验Y所用的试剂是________________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是_______(填序号)。
a.Na2S + S b.Na2SO3 + S c.Na2SO3 + Na2SO4d.SO2 + Na2SO4
(4)将X与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有N、P、Fe、Ti等元素的新型材料有着广泛的用途。
(1)基态Fe原子未成对电子数为______个;基态Ti原子的价电子排布图是_____________。
(2)意大利罗马大学的:FuNvio Cacace等人获得了极具理论研究意义的N4分子,其中氮原子的轨道杂化形式为__________________________。
(3)比较气态氢化物膦(PH3)和氨(NH3)的键角:PH3________NH3(填“大于”、“小于”或“等于”),主要原因为____________________________________________________________。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如图所示。

①组成M的元素中,电负性最大的是___________(填名称)。
②M中含有_________(填标号)。
A π键 B σ键
C 离子键 D 配位键

(5)已知金刚石的晶胞沿其体对角线垂直在纸平面上的投影图如下图B所示,则金属铁晶胞沿其体对角线垂直在纸平面上的投影图应该是图__________(填标号)。

(6)某种磁性氮化铁的晶胞结构如图所示,其中距离铁原子最近的铁原子的个数为____________,氮化铁晶胞底边长为a cm,高为c cm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 电子由低能级跃迁至较高能级时,可通过光谱仪直接摄取原子的发射光谱
B. 基态原子的核外电子排布为[Kr]4d105s1的元素属于d区
C. NH3和CH4的中心原子都是sp3杂化
D. SO2和CO2都是直线形分子,其中心原子都是sp杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH是溶液中c(H+)的负对数,若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,某浓度的草酸(H2C2O4)水溶液中pC(H2C2O4),pC(HC2O4-)、pC(C2O42-)随着溶液pH的变化曲线如图所示:下列说法不正确的是

A. 曲线I代表HC2O4-的浓度随着pH增大先变小后变大
B. 草酸的电离常数 Kal=l×10-1.3; Ka2= l×10-4.3
C. pH=4时,c(HC2O4-)>c(C2O42-)>c(H2C2O4)
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,圆底烧瓶中盛有 0.18g 镁条,加入 10.00mL2.00mol/L 的硫酸溶液 反应完全后,产生氢气 180mL。
(1)根据实验数据计算,气体的摩尔体积为_____。
(2)反应过程中,装置内空气没有排除,空气的体积对实验结果____(填“有”或“无”)影响,请简述理由:________
(3)有同学认为:若镁条中混有杂质,则实验结果会偏低。请列举实例分析该同学的观点是否正确?____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
氢化反应: ,
,![]()
副反应: ,
,![]()
解聚反应: ,
,![]()
回答下列问题:
(1)反应![]() 的△H= _____ kJ/mol。
的△H= _____ kJ/mol。
(2)一定条件下,将环戊二烯溶于有机溶剂进行氢化反应(不考虑二聚反应),反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如图所示:

①0~4h氢化反应速率比副反应快的可能原因是_________。
②最佳的反应时间为__h。若需迅速减慢甚至停止反应,可采取的措施有____(写一条即可)。
③一段时间后,环戊烯产率快速下降的原因可能是_________。
(3)解聚反应在刚性容器中进行(不考虑氢化反应和副反应)。
①其他条件不变,有利于提高双环戊二烯平衡转化率的是 ____(填标号)。
A.增大双环戊二烯的用量 B.使用催化剂 C.及时分离产物 D.适当提高温度
②实际生产中常通入水蒸气以降低双环戊二烯的温度(水蒸气不参与反应)。某温度下,通入总压为300 kPa的双环戊二烯和水蒸气,达到平衡后总压为500 kPa,双环戊二烯的转化率为80%,则p(H2O)=______kPa,平衡常数Kp=_______kPa (Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种位于不同主族的短周期元素X、Y、Z、W的原子序数依次增大,![]() 的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
A. 四种元素中至少有两种金属元素
B. 四种元素的常见氢化物中熔点最高的是![]() 的氢化物
的氢化物
C. 四种元素形成的简单高子中,离子半径最小的是元素![]() 形成的离子
形成的离子
D. 常温下,![]() 三种元素形成的化合物的水溶液的
三种元素形成的化合物的水溶液的![]() 小于7
小于7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com