
 CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.| 浓度(mol/L) 物质 时间/min | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2 | 0.13 | 0.1 | 0.1 | 0.09 |
| H2 | 0 | 0.21 | 0.3 | 0.3 | 0.33 |
分析 (1)根据热化学方程式的书写方法,先写出方程式并标注状态,再根据热量与化学计量数计算焓变;
(2)①反应方程式为CH4(g)+H2O(g)=CO(g)+3H2(g)根据三行式代入平衡常数表达式进行计算;
②根据表中数据可知3min时达到平衡,再根据4min时各组分浓度变化量判断改变的条件;
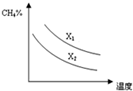
(3)碳水比n(CH4)/n(H2O)值越大,平衡时甲烷的转化率越低,含量越高.
解答 解:(1)根据热化学方程式的书写方法,先写出方程式并标注状态,再根据热量与化学计量数计算焓变,则用甲烷与水蒸气制备合成气,每生成1mol合成气,需要吸收51.5kJ热量,该反应的热化学方程式为:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206KJ/mol,
故答案为:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206KJ/mol;
(2)①反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g),
初起量(mol•L-1):0.2 0.3 0 0
变化量(mol•L-1):0.1 0.1 0.1 0.3
平衡量(mol•L-1):0.1 0.2 0.1 0.3
所以K=$\frac{c(CO)•{c}^{3}({H}_{2})}{c(C{H}_{4})•c({H}_{2}O)}$=$\frac{0.1×0.{3}^{3}}{0.1×0.2}$=0.135,
故答案为:0.135;
②3min时改变的反应条件,反应向正反应方向进行,可能为升高温度或增大H2O的浓度或减小CO的浓度,
故答案为:升高温度或增大H2O的浓度或减小CO的浓度;
(3)碳水比n(CH4)/n(H2O)值越大,平衡时甲烷的转化率越低,含量越高,故x1>x2,
故答案为:>.
点评 本题综合性较大,涉及化学平衡图象、化学平衡的影响因素、化学平衡计算、化学计算、离子浓度比较等,为高考常见题型,难度中等,是对基础知识与学生能力的综合考查,注意把握化学平衡的影响因素以及图象、数据的分析能力的培养.


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:解答题
| 实验 | 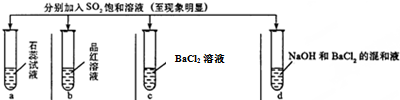 | ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 红色 | 无色 | 无色溶液 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分解温度:CH4>H2S | B. | 氧化性:NaClO>Na2SO3 | ||
| C. | 同浓度溶液pH:Na2SiO3>Na2CO3 | D. | 金属性:Ca>Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4.6g NO2或N2O4气体中所含原子总数均为0.3NA | |
| B. | 标准状况下,22.4 mL Br2所含的分子数为0.001NA | |
| C. | 标准状况下,22.4L的Cl2与1mol Fe充分反应,转移的电子数为3NA | |
| D. | 100 mL 0.1 mol•L-1的H2SO3溶液中,电离出的H+总数为0.02 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH21,3-二丁烯 | B. | CH3COOCH2CH2OOCCH3乙二酸二乙酯 | ||
| C. | 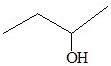 3-丁醇 3-丁醇 | D. | 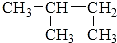 2-甲基丁烷 2-甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
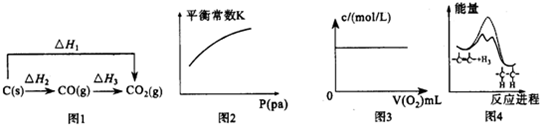 ( )
( )| A. | 图1中的△H1>△H2 | |
| B. | 对于可逆反应A(s)+3B(g)?2C(g)△H>0,压强对平衡常数K的影响符合图2 | |
| C. | 图3表示充满NO2气体的试管,倒置于水槽中,向其中缓慢通入氧气直至试管中全部充满水,假设溶质不扩散,溶质的物质的量浓度与通入氧气的体积关系 | |
| D. | 由图4可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 环境要求 | 离子 |
| A | 溶液中c(K+)<c(Cl-) | K+、AlO2-、Cl-、NO3- |
| B | NaHCO3溶液 | K+、ClO-、AlO2- |
| C | 水电离产生的c(H+)=10-12 mol/L-1的溶液 | ClO-、CO32-、NH4+、NO3-、SO32- |
| D | 逐滴滴加氨水立即有沉淀产生 | Na+、HCO3-、Mg2+、SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| B. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 | |
| C. | 负极的电极反应式为Al-3e-═Al3+ | |
| D. | 电解质溶液可以是氢氧化钠溶液或者稀硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com