
| A. | CH2=CH-CH=CH21,3-二丁烯 | B. | CH3COOCH2CH2OOCCH3乙二酸二乙酯 | ||
| C. | 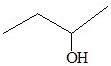 3-丁醇 3-丁醇 | D. | 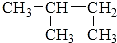 2-甲基丁烷 2-甲基丁烷 |
分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
1)命名要符合“一长、一近、一多、一小”,也就是主链最长,编号起点离支链最近,支链数目要多,支链位置号码之和最小;
2)有机物的名称书写要规范;
3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名.
4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A.CH2=CH-CH=CH2结构中含有2个碳碳双键,是二烯烃,正确的名称为1,3-丁二烯,故A错误;
B.CH3COOCH2CH2OOCCH3由两分子乙酸与乙二醇形成的二元酯,正确的名称为二乙酸乙二酯,故B错误;
C.物质 从离羟基近的一端编号,正确的名称为2-丁醇,故C错误;
从离羟基近的一端编号,正确的名称为2-丁醇,故C错误;
D.符合烷烃命名原则,故D正确.
故选D.
点评 本题考查了有机物的命名知识.一般要求了解烷烃的命名、苯的同系物的命名及简单的烃的衍生物的命名,难度不大,命名时要遵循命名原则,书写要规范.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
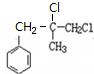 .
.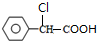 +2NaOH $→_{△}^{水}$
+2NaOH $→_{△}^{水}$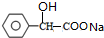 +NaCl+H2O.其反应类型为水解反应、中和反应.
+NaCl+H2O.其反应类型为水解反应、中和反应.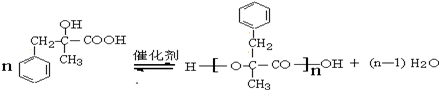 .
.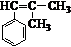 ,而不是
,而不是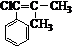 或
或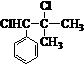 的原因是因为该条件下与双键相连的甲基上的氢原子更易取代.
的原因是因为该条件下与双键相连的甲基上的氢原子更易取代.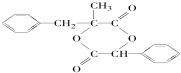 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | Si-Si | Si-H |
| 键能(KJ/mol) | 356 | 413 | 226 | 318 |
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
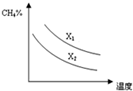 CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.| 浓度(mol/L) 物质 时间/min | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2 | 0.13 | 0.1 | 0.1 | 0.09 |
| H2 | 0 | 0.21 | 0.3 | 0.3 | 0.33 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,6.0gNO和2.24LO2混合,所得气体的分子数目为0.2NA | |
| B. | 常温常压下,1 L0.1mol•L-1的硝酸铵溶液中氮原子数目为0.2NA | |
| C. | 1 mol有机物 中最多有6 NA个原子在一条直线上 中最多有6 NA个原子在一条直线上 | |
| D. | 1 mol甲基( 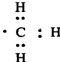 )所含的电子数为7 NA )所含的电子数为7 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片不用特殊方法保护 | |
| B. | 轮船水线下的船体上装一定数量的锌块 | |
| C. | 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后速率增大 | |
| D. | 镀锌铁比较耐用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com