
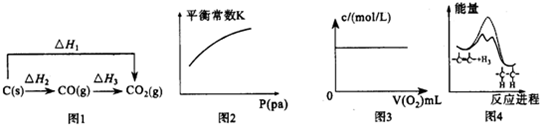
 ( )
( )| A. | 图1中的△H1>△H2 | |
| B. | 对于可逆反应A(s)+3B(g)?2C(g)△H>0,压强对平衡常数K的影响符合图2 | |
| C. | 图3表示充满NO2气体的试管,倒置于水槽中,向其中缓慢通入氧气直至试管中全部充满水,假设溶质不扩散,溶质的物质的量浓度与通入氧气的体积关系 | |
| D. | 由图4可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行 |
分析 A.根据盖斯定律,且△H1=△H2+△H3;
B.平衡常数只与温度有关;
C.试管中发生的总反应为4NO2+O2+2H2O=4HNO3所以在标况下浓度均为$\frac{4}{5}×\frac{1}{22.4}$;
D.催化剂会降低反应的活化能.
解答 解:A.△H1、△H2、△H3均小于零,且△H1=△H2+△H3,故A错误;
B.平衡常数不会随压强的改变而改变,故B错误;
C.试管中发生的总反应为4NO2+O2+2H2O=4HNO3所以在标况下浓度均为$\frac{4}{5}×\frac{1}{22.4}$,故C正确;
D.催化剂会降低反应的活化能,故D错误.
故选:C.
点评 本题考查盖斯定律、平衡常数、催化剂的影响、相关计算,属于中等难度题目,考查学生的基础知识和基本技能.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.| 浓度(mol/L) 物质 时间/min | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2 | 0.13 | 0.1 | 0.1 | 0.09 |
| H2 | 0 | 0.21 | 0.3 | 0.3 | 0.33 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
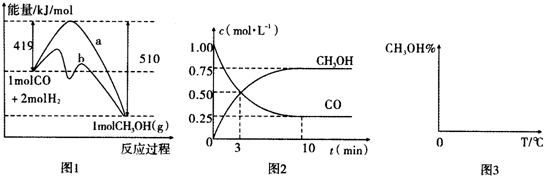
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于C2H4(g)+H2O(g)═C2H5OH(g)在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为l mol,则用分压表示的平衡常数Kp=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)═2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol.若此时A、B和C均增加1 mol,平衡正向移动 | |
| C. | 一恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)═2NH3(g)达到平衡状态时,N2、H2、NH3各l mol,若此时再充入3mol N2,则平衡正向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
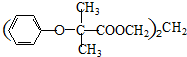
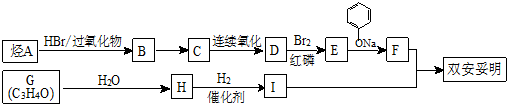
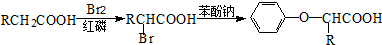
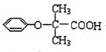 .
.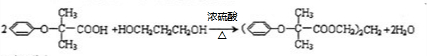 .
. .
.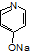 (
(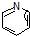 与
与 苯环性质相似)与
苯环性质相似)与 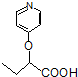 合成的路线:
合成的路线: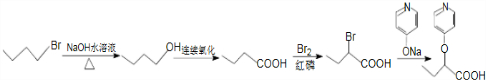 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2 | B. | C3H4 | C. | C4H6 | D. | C5H8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com