
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)表中元素原子半径最大的是(写元素符号)___,Y原子的电子排布式是__,Z原子核外电子能量最高的电子亚层是___。
(2)下列事实能说明Y元素的非金属性比S元素强的是___;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y单质比1mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)CCl4是一种常见的有机溶剂,写出其电子式___,判断其属于含有___(填“极性”、“非极性”)共价键的____分子(填“极性”或“非极性”)。SiH4的沸点比CH4高,原因是___。
(4)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式说明产生该现象的原因:___,在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因____。
【答案】Si 1s22s22p4 3p ac 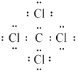 极性 非极性 SiH4与CH4都是分子晶体,结构相似,分子晶体的熔沸点与式量有关,式量越大,分子间作用力越大,熔沸点越高,SiH4的式量大于CH4,故SiH4的沸点比CH4高 CO32-+H2O
极性 非极性 SiH4与CH4都是分子晶体,结构相似,分子晶体的熔沸点与式量有关,式量越大,分子间作用力越大,熔沸点越高,SiH4的式量大于CH4,故SiH4的沸点比CH4高 CO32-+H2O![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH- 加入氯化钙后,CO32-+Ca2+=CaCO3↓,促使上述平衡左移,OH-浓度减少,故溶液颜色变浅
H2CO3+OH- 加入氯化钙后,CO32-+Ca2+=CaCO3↓,促使上述平衡左移,OH-浓度减少,故溶液颜色变浅
【解析】
根据元素在周期表中的相对位置,X是硅元素、Y是氧元素、Z是氯元素。
(1)电子层数越多半径越大,电子层数相同时,质子数越多半径越小,表中元素原子半径最大的是Si,Y是氧元素,氧原子的电子排布式是1s22s22p4,Z是氯元素,氯原子的电子排布式是1s22s22p63s23p5,核外电子能量最高的电子亚层是3p。
(2)a.氯气与H2S溶液反应,溶液变浑浊,说明有硫单质生成,可知氯气氧化性大于硫,所以Cl元素的非金属性比S元素强,故选a;b.氧化性与元素得电子难易有关,与得电子多少无关,故不选b;c.元素非金属性越强,其气态氢化物越稳定,Cl和S两元素的简单氢化物受热分解,HCl的分解温度高,说明Cl元素的非金属性比S元素强,故选c;答案选ac;
(3)CCl4是共价化合物,各原子都满足8电子结构,其电子式是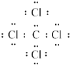 ,C-Cl键是不同原子形成的共价键,属于极性键,CCl4具有正四面体结构,正负电荷的重心重合,属于非极性分子,所以CCl4是含有极性共价键的非极性分子。SiH4与CH4都是分子晶体,结构相似,分子晶体的熔沸点与式量有关,式量越大,分子间作用力越大,熔沸点越高,SiH4的式量大于CH4,故SiH4的沸点比CH4高。
,C-Cl键是不同原子形成的共价键,属于极性键,CCl4具有正四面体结构,正负电荷的重心重合,属于非极性分子,所以CCl4是含有极性共价键的非极性分子。SiH4与CH4都是分子晶体,结构相似,分子晶体的熔沸点与式量有关,式量越大,分子间作用力越大,熔沸点越高,SiH4的式量大于CH4,故SiH4的沸点比CH4高。
(4)碳酸钠溶液中滴入酚酞,溶液显红色,溶液呈碱性,说明碳酸根离子发生水解反应,水解的离子方程式是CO32-+H2O![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH-,在上述红色的溶液中加入少许氯化钙固体,发生反应CO32-+Ca2+=CaCO3↓,碳酸根离子浓度减小,促使上述平衡左移,OH-浓度减少,故溶液颜色变浅。
H2CO3+OH-,在上述红色的溶液中加入少许氯化钙固体,发生反应CO32-+Ca2+=CaCO3↓,碳酸根离子浓度减小,促使上述平衡左移,OH-浓度减少,故溶液颜色变浅。


科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液中,产物中可能含有KCl、KClO、KClO3,且![]() 的值与温度高低有关。当n(KOH)=a mol时,下列说法不正确的是
的值与温度高低有关。当n(KOH)=a mol时,下列说法不正确的是
A.参加反应的氯气的物质的量等于![]() a mol
a mol
B.改变温度,产物中KClO3的最大理论产量为![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n(e-)的范围为![]() a mol≤n(e-)≤
a mol≤n(e-)≤![]() a mol
a mol
D.若某温度下,反应后![]() =11,则溶液中
=11,则溶液中![]() =
=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol的KCl和0.1mol的AlCl3溶于水配成100mL混合溶液,下列溶液中Cl-浓度与该混合溶液中Cl-浓度相等的是
A. 3mol/L的NaCl溶液 B. 2mol/L的FeCl3溶液
C. 2mol/L的MgCl2溶液 D. 2mol/L的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知图一表示的是可逆反应 CO(g)+H2(g)![]() C(s)+H2O(g)-Q(Q>0)的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g)-Q(Q>0)的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)![]() N2O4(g)+Q(Q>0)的浓度(c)随时间 t 的变化情况,下列 说法中正确的是
N2O4(g)+Q(Q>0)的浓度(c)随时间 t 的变化情况,下列 说法中正确的是
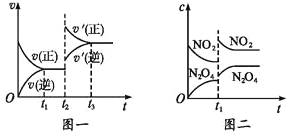
A.图一 t2 时刻改变的条件可能是升高了温度或增大了压强
B.图一 t2 时刻改变的条件可能是通入了 CO 气体
C.图二 t1 时刻改变的条件可能是升高了温度或增大了压强
D.图二 t1 时刻改变的条件是增大压强,则混合气体的平均相对分子质量将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,研究非金属元素性质变化规律。
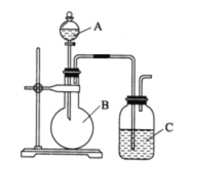
已知:高锰酸钾在常温下与浓盐酸反应产生氯气,离子方程式为______。
(1)如果C中装饱和的H2S溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,证明氯的非金属性比硫的非金属性________(填“强”或“弱”或“无法判断”;请用电子式表示H2S的形成过程:_____。
(2)利用如图装置证明Cl2氧化性强于I2的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末, C中装入淀粉KI溶液,则C中现象是______。
(3)现有浓硝酸、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:非金属性:N > C > Si。C中装试剂______,实验现象为_________该装置存在不足之处,改进措施为:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁﹣次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣下列有关说法正确的是( )
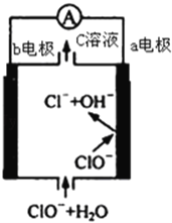
A. 电池工作时,C溶液中的溶质是MgCl2
B. 电池工作时,正极a附近的pH将不断增大
C. 负极反应式:ClO﹣﹣2e﹣+H2O═Cl﹣+2 OH﹣
D. b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨和制硫酸是中学阶段重要的化工生产反应。
(1)硫酸工业生产中接触室内发生的反应方程式为___;在实际生产过程中,操作温度选定400-500摄氏度,压强采用常压的原因分别是___。
(2)合成氨反应生成的氨气可用于工业制纯碱,写出以氨气、氯化钠、二氧化碳、水为原料制备纯碱的化学方程式___、___。
(3)合成氨每生成1g液氨,放出QkJ的热量,写出热化学反应方程式___。
(4)常用浓氨水来检查输氯管道是否泄漏,泄漏处会观察到大量的白烟(NH4Cl),还生成一种无色无味的单质气体,写出此反应的化学方程式并标出电子转移的方向和数目____,该反应中被还原的是___,还原产物是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)“套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两只或更多试管进行的实验。因其有许多优点,近年来被广泛开发并应用于化学实验中。下面这个实验为“套管实验”,实验装置如下图,小试管中部有沾上无水硫酸铜粉末的脱脂棉。请观察实验装置,分析实验原理,并回答下列问题:
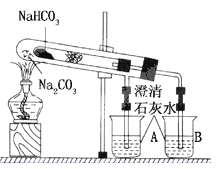
(1)整个实验过程中,能观察到的现象为
①烧杯A中________;②小试管中________;
③烧杯B中____________________________;
(2)实验结束时,在操作上要特别注意的问题是
____________________________________________________________________
(3)写出实验过程中发生反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从电镍含钴废渣(主要成分有Co(OH)3、Ni(OH)3、Fe(OH)3及少量Ca(OH)2、Mg(OH)2等杂质)中提取氧化钴(Co2O3)的工艺流程如下:
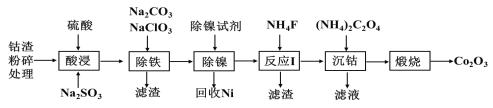
已知:Ksp(CaF2)=3.45×10-11,Ksp(MgF2)=7.42×10-11,Ksp[Co(OH)3]=2×10-44。
(1)在还原剂Na2SO3存在的条件下,钴渣易溶于酸中,请写出酸浸时Co(OH)3与Na2SO3反应的离子方程式______,该步操作中硫酸不宜过量太多的主要原因是 ____。
(2)除铁操作中Fe3+以黄钠铁矾Na2Fe6(SO4)4(OH)12形式从溶液中沉淀析出。中学检验Fe3+的溶液中混有Fe2+的常用试剂是________。
(3)反应Ⅰ中加入NH4F的目的______。
(4)沉钴操作发生的反应为(NH4)2C2O4+CoCl2![]() CoC2O4↓+2NH4Cl,也可用Na2C2O4代替(NH4)2C2O4,若要得到较为纯净的CoC2O4,则合理的加料方式是______(填字母)。
CoC2O4↓+2NH4Cl,也可用Na2C2O4代替(NH4)2C2O4,若要得到较为纯净的CoC2O4,则合理的加料方式是______(填字母)。
a.将Na2C2O4溶液与反应Ⅰ滤液同时加入到反应容器中
b.将Na2C2O4溶液缓慢加入到盛有反应Ⅰ滤液的反应容器中
c.将反应Ⅰ滤液缓慢加入到盛有Na2C2O4溶液的反应容器中
(5)450℃在空气中煅烧发生的化学反应方程式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com