
����Ŀ��(15��)����ʵ�����ǽ�һ֧��С���Թ�װ����һ�Թ��У�����װ�����ԭ����Ҫ��ֻ������Թܽ��е�ʵ�顣�����������ŵ㣬���������㷺������Ӧ���ڻ�ѧʵ���С��������ʵ��Ϊ����ʵ������ʵ��װ������ͼ��С�Թ��в���մ����ˮ����ͭ��ĩ����֬�ޡ���۲�ʵ��װ�ã�����ʵ��ԭ�������ش��������⣺
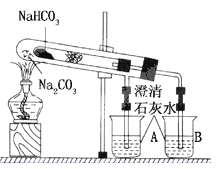
(1)����ʵ������У��ܹ۲쵽������Ϊ
���ձ�A��________����С�Թ���________��
���ձ�B��____________________________��
(2)ʵ�����ʱ���ڲ�����Ҫ�ر�ע���������
____________________________________________________________________
(3)д��ʵ������з�����Ӧ�Ļ�ѧ����ʽ
���𰸡���1����������ð����
����֬�ޱ����ɫ,�Թ��ڱ���ˮ�������
�������ݲ���,����ʯ��ˮ����ǣ�
(2)�Ƚ������ܴ�A��B�ձ���ȡ��,��ֹͣ���ȣ�
(3) ��CuSO4+5H2O=CuSO45H2O����2NaHCO3=Na2CO3+CO2+H2O����CO2+Ca(OH)2�TCaCO3��+H2O��
��������
(1)�ټ���ʱ,���Թ���������������,���Թ۲쵽�ձ�A�������ݲ�����
��̼���������ȷֽ�����̼���ơ�������̼�ͻ�,��ɫ������ͭ��ˮ��Ӧ������ɫ����ˮ����ͭ��
��̼�����Ʒֽ����ɵĶ�����̼�����ʯ��ˮ��Ӧ����̼��Ƴ���;
(2)ʵ�����ʱ,Ϊ�˱��ⷢ����������,Ӧ���ȳ���������Ϩ��ƾ��ƣ�
(3)ʵ������з����ķ�Ӧ����ʽ��:̼�����ƵķֽⷴӦ����ˮ����ͭ��ˮ�ķ�Ӧ��������̼���������Ƶķ�Ӧ,�ݴ�д����Ӧ�Ļ�ѧ����ʽ��
��1����ʵ�鿪ʼʱ,���Թ��е�������������,�ձ�A�ĵ������л�������ð����
����������������ȷ�𰸣�������ð����
��С�Թ��в���մ����ˮ����ͭ��ĩ����֬�ޱ����ɫ,�Թ��ڱ���ˮ�������
����������������ȷ�𰸣���֬�ޱ����ɫ,�Թ��ڱ���ˮ�������
��̼�����Ƽ��ȷֽ����ɶ�����̼����,������̼�����ʯ��ˮ��Ӧ����̼��Ƴ���,�����ձ�B�е������������ݲ���,����ʯ��ˮ����ǣ�
����������������ȷ�𰸣������ݲ���,����ʯ��ˮ����ǣ�
(2)ʵ�����ʱ,�ڲ�����Ҫ�ر�ע��:�Ƚ������ܴ�A��B�ձ���ȡ��,��ֹͣ����,�Է�����
����������������ȷ�𰸣��Ƚ������ܴ�A��B�ձ���ȡ��,��ֹͣ���ȣ�
(3)ʵ������з�����Ӧ�Ļ�ѧ����ʽ��:
����ɫ��ˮ��Ӧ������ˮ����ͭ,��Ӧ�Ļ�ѧ����ʽΪ:CuSO4+5H2O=CuSO45H2O��
��̼���������ȷֽ�����̼���ơ�������̼�����ˮ:2NaHCO3=Na2CO3+CO2+H2O��
������̼�����ʯ��ˮ��Ӧ����̼��Ƴ�����ˮ,��Ӧ�Ļ�ѧ����ʽΪ:CO2+Ca(OH)2�TCaCO3��+H2O��
��ˣ�������ȷ����:��CuSO4+5H2O=CuSO45H2O����2NaHCO3=Na2CO3+CO2+H2O����CO2+Ca(OH)2�TCaCO3��+H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ǧ��ƵĻ�ѧ���ʺ�Ϊ���ڶ�Ļ�ѧ��Ӧ�����෨�����ü������ɴ���ġ�
��.�����������ʣ���H2O����Cu����BaCO3 ��Fe(OH)3���塡�ݾƾ�����CO2����ϡ����
(1)�������������ڻ�������________(����ţ���ͬ)�����ڵ���ʵ���________��
(2)�������εμӢߣ��ɹ۲쵽��������_____________________��
��.��Ȼ����ķ�����ͬ�������ֻ�����Ӧ���ͺ����ӷ�Ӧ��������ԭ��Ӧ֮��Ҳ������һ���Ĺ�ϵ��
(3)��ͼΪ���ӷ�Ӧ��������ԭ��Ӧ���û���Ӧ����֮��Ĺ�ϵ�����б�ʾ���ӷ�Ӧ����________(����ĸ)��
![]()
(4)��ͬѧ��Ϊ��������кͷ�Ӧ���ɱ�ʾΪH��+OH-=H2O����ٸ����ӷ��������۵�(�����ӷ���ʽ��ʾ)_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֡�
̼ | �� | Y | |
X | �� | Z |
�ش��������⣺
��1������Ԫ��ԭ�Ӱ뾶�����ǣ�дԪ�ط��ţ�___��Yԭ�ӵĵ����Ų�ʽ��__��Zԭ�Ӻ������������ߵĵ����Dz���___��
��2��������ʵ��˵��YԪ�صķǽ����Ա�SԪ��ǿ����___��
a.Y������H2S��Һ��Ӧ����Һ�����
b.��������ԭ��Ӧ�У�1mol Y���ʱ�1mol S�õ��Ӷ�
c.Y��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
��3��CCl4��һ�ֳ������л��ܼ���д�������ʽ___���ж������ں���___������ԡ������Ǽ��ԡ������ۼ���____���ӣ�����ԡ��Ǽ��ԡ�����SiH4�ķе��CH4�ߣ�ԭ����___��
��4��̼������Һ�е����̪����Һ�Ժ�ɫ���������ӷ���ʽ˵�������������ԭ��___����������ɫ����Һ�м��������Ȼ��ƹ��壬��Һ��ɫ��dz������ƽ�����۽��Ͳ����������ԭ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������0.5LijȪˮ��Ʒ�����к���Ca2+0.02g������㣺
��1����Ȫˮ��Ʒ��Ca2+�����ʵ���Ũ���Ƕ���___��
��2��Ϊʹ��Ȫˮ��Ʒ��������Ca2+ȫ������������Ӧ����Na2CO3�����ʵ����Ƕ���___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X��һ��ҽҩ�м��壬��ṹ��ʽ��ͼ��ʾ�������йػ�����X��˵����ȷ���ǣ� ��
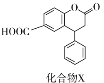
A. ��������������һ������ͬһƽ��
B. �����뱥��Na2CO3��Һ��Ӧ
C. ������������ˮ�⣬ˮ�����ֻ��һ��
D. 1mol������X�������1 molNaOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������amol�����ƺ�bmol�������ĺϽ�Ͷ��mg����ˮ�У���ȫ�ܽ⣬����ʣ�࣬������Һ�ܶ�Ϊdgcm��3��������ؼ���ʽ���д�����ǣ�������
A.NaOH�����ʵ�������a��b��mol
B.NaAlO2�����ʵ���Ũ�ȣ�![]() mol/L
mol/L
C.���������H2�������![]() L
L
D.�μӷ�Ӧ��ˮ��������18��a+1.5b��g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1mol CH4���������������ܱ������е�ȼ����ַ�Ӧ�������������ʣ�࣬�Ҳ����Ϊ���� (101 kPa��120��)����������Ϊ72g�������й���������ȷ����
A. ��������ͨ����ʯ�ң�����ȫ�������գ���ͨ��Ũ���ᣬ����ȫ��������
B. �����ƽ��Ħ������Ϊ42g/mol
C. ��������ͨ��Ũ���������պ�ָ���101kPa��120�棬��ѹǿ��Ϊԭ����1/3
D. ��Ӧ����������Ϊ56g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������0.1molL��1������Һ��pH=a��������ʹ��ҺpH=��a+1���Ĵ�ʩ��
A. ����Һϡ�͵�ԭ�����2��B. ���������Ĵ����ƹ���
C. ��������0.2 molL��1����D. ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������20 mLŨ�Ⱦ�Ϊ0.1 mol��L��1 NH4HSO4 ��(NH4)2SO4�����Һ����μ���0.1mol��L��1��Ba(OH)2��Һ����ַ�Ӧ���ã�Ba(OH)2��Һ�������Һ��pH�Ĺ�ϵ����ͼ������˵����ȷ���ǣ�������������ɵ�NH3��H2O���ֽ⣩
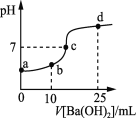
A.a����Һ�У�c(NH4+)��c(NH3��H2O)��0.4 mol��L��1
B.b����Һ�У�c(NH4+)��c(SO42-)��c(H��)��c(NH3��H2O)��c(OH��)
C.c����Һ�У�c(Ba2��) �� c(NH4+)��c(SO42-)
D.d����Һ�У�c(NH3��H2O)��c(SO42-)��c(NH4+)��c(OH��)��c(H��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com