
【题目】将含amol金属钠和bmol金属铝的合金投入mg足量水中,完全溶解,无金属剩余,所得溶液密度为dgcm﹣3,下列相关计算式子中错误的是( )
A.NaOH的物质的量:(a﹣b)mol
B.NaAlO2的物质的量浓度:![]() mol/L
mol/L
C.标况下生成H2的体积:![]() L
L
D.参加反应的水的质量:18(a+1.5b)g
【答案】D
【解析】
发生反应:2Na+2H2O═2NaOH+H2↑和2Al+2NaOH+2H2O=2NaAlO2+3H2↑,所得溶液转化溶质为NaAlO2或者为NaOH、NaAlO2。
A.由Al原子守恒,可知n(NaAlO2)=n(Al)=bmol,由Na原子守恒可知:n(NaOH)=n(Na)﹣n(NaAlO2)=(a﹣b)mol,故A正确;
B.根据电子转移守恒,可知n(H2)=![]() =(0.5a+1.5b)mol,故溶液质量=(23a+27b+m)g﹣(0.5a+1.5b)mol×2g/mol=(22a+24b+m)g,溶液的体积为(22a+24b+m)g÷1000d/L=
=(0.5a+1.5b)mol,故溶液质量=(23a+27b+m)g﹣(0.5a+1.5b)mol×2g/mol=(22a+24b+m)g,溶液的体积为(22a+24b+m)g÷1000d/L=![]() L,故c(NaAlO2)=bmol÷
L,故c(NaAlO2)=bmol÷![]() L=
L=![]() mol/L,故B正确;
mol/L,故B正确;
C.标况下生成氢气的体积为:(0.5a+1.5b)mol×22.4L/mol=![]() L,故C正确;
L,故C正确;
D.由方程式可知,参加反应的水的物质的量为(a+b)mol,故参加反应的水为18(a+b)g,故D错误。
故选:D。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】若 m g Na在足量氯气中燃烧,生成固体的质量为(m+3.55)g,则 m g Na与氧气反应,生成的固体的质量为:①2.7g、②3.1g、③3.55g、④3.9g、⑤4.0g( )
A.①②③B.②③④C.③④⑤D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁﹣次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣下列有关说法正确的是( )
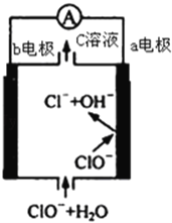
A. 电池工作时,C溶液中的溶质是MgCl2
B. 电池工作时,正极a附近的pH将不断增大
C. 负极反应式:ClO﹣﹣2e﹣+H2O═Cl﹣+2 OH﹣
D. b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结面成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结钩如图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是
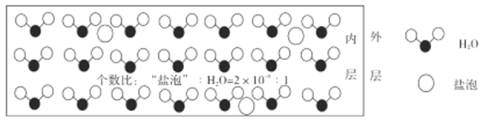
A.海冰内层“盐泡”越多,密度越小
B.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
C.海冰内层NaCl的浓度约为10-4mol/L(设冰的密度为0.9g/cm3)
D.海冰冰龄越长,内层的“盐泡”越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)“套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两只或更多试管进行的实验。因其有许多优点,近年来被广泛开发并应用于化学实验中。下面这个实验为“套管实验”,实验装置如下图,小试管中部有沾上无水硫酸铜粉末的脱脂棉。请观察实验装置,分析实验原理,并回答下列问题:
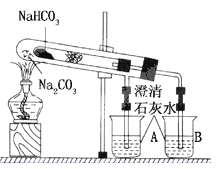
(1)整个实验过程中,能观察到的现象为
①烧杯A中________;②小试管中________;
③烧杯B中____________________________;
(2)实验结束时,在操作上要特别注意的问题是
____________________________________________________________________
(3)写出实验过程中发生反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是( )
A.化学反应中电子转移的表示方法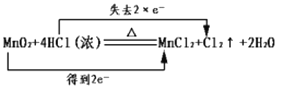
B.离子M2O7x-与S2-能在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+=2M3+ +3S +7H2O,则M2O7x-中M的化合价为+7
C.在常温下发生以下几个反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O②2A2++B2=2A3++2B-③2B-+Z2 =B2+2Z-根据上述反应,可知道氧化性强弱顺序为:XO4->Z2>B2>A3+
D.已知硝酸铵在一定温度下分解为5NH4NO3=4N2↑+2HNO3+9H2O↑,被氧化的元素和被还原的元素的质量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中,A为一种中学化学中常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色实验均为黄色。

(1)写出下列物质的化学式:B___。
(2)以上6个反应中属于氧化还原反应的有___(填写编号)。
(3)写出A →C反应的离子方程式___。
(4)写出B→C反应的离子方程式:___;E→D的化学方程式:___。
(5)加热5.00gD和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31g,则原混合物中D的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某研究小组探究SO2和Fe(NO3)3溶液的反应。
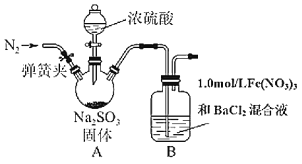
已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,铁架台等夹持仪器已略去,请回答:
(1)用于加入浓硫酸的仪器名称为 ________。装置A中发生的化学方程式为______。
(2)滴加浓硫酸之前要先打开弹簧夹通入一定量的N2,其目的是_____________。
(3)实验中,装置B中产生了白色沉淀,该沉淀的成分是_______,说明SO2具有______性。
(4)分析B中产生白色沉淀的原因:
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
基于观点1,装置B中反应的离子方程式___________。
为证明该观点,应进一步检验生成的新物质,其实验操作及现象为(假定在反应中SO2的量不足_________。
基于观点2,只需将装置B中Fe(NO3)3溶液替换为等体积的下列溶液,在相同的条件下进行实验。应选择的最佳试剂是 _________ (填序号)。
A.0.1 mol·L-1的稀硝酸 B. 1.5 mol·L-1的Fe(NO3)3溶液
C.6.0 mol·L-1的NaNO3和0.2 mol·L-1盐酸等体积混合的混合液
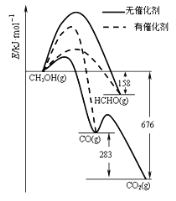
Ⅱ.人们常用催化剂来选择反应进行的方向。 图所示为一定条件下1 mol CH3OH与O2发生反应时生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成_____(填“CO” 、“CO2”或“HCHO”);2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
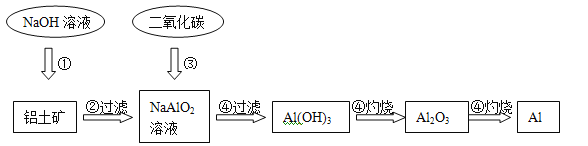
(1)请用离子方程式表示以上工艺流程中第①步反应:__ _______。
(2)写出以上工艺流程中第③步反应的化学方程式:_ _____。
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应。该反应的化学方程式_____________。请举一例该反应的用途_____________。
(4)电解熔融氧化铝制取金属铝,若有0.9mol电子发生转移.理论上能得到金属铝的质量是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com