
【题目】海冰是海水冻结面成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结钩如图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是
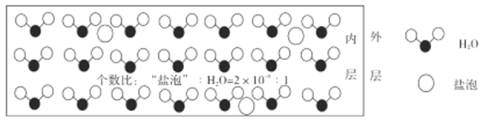
A.海冰内层“盐泡”越多,密度越小
B.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
C.海冰内层NaCl的浓度约为10-4mol/L(设冰的密度为0.9g/cm3)
D.海冰冰龄越长,内层的“盐泡”越多
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图所示。

(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接___;__接__。
(2)装置中,饱和食盐水的作用是___;NaOH溶液的作用是___。
(3)化学实验中常用湿润的KI-淀粉试纸检验是否有Cl2产生。如果有Cl2产生,可观察到___,反应的化学方程式为___。
(4)写出下列反应的化学方程式:
①气体发生装置中进行的反应:___。
②NaOH溶液中发生的反应:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),现用如图1装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:
2PbSO4(s)+2H2O(l),现用如图1装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:
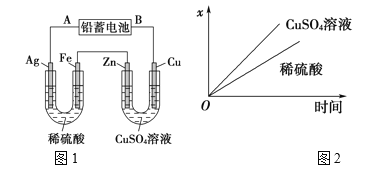
(1)A是铅蓄电池的________极,铅蓄电池正极反应式为:______。
(2)Ag电极的电极反应式是______,该电极的电极产物共________g。
(3)Cu电极的电极反应式是________,CuSO4溶液的浓度_______(填“减小”“增大”或“不变”)。
(4)如图2表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示_______。
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用胆矾(化学式![]() )配制100mL0.1mol/L的CuSO4溶液。已知胆矾溶于水的过程吸收热量。
)配制100mL0.1mol/L的CuSO4溶液。已知胆矾溶于水的过程吸收热量。
(1)配制该CuSO4溶液所需容量瓶的规格是___。
(2)同学们进行了以下操作,请将空白处填写完整。
①在托盘天平上称得相应质量的胆矾,将其放在___中,加入适量蒸馏水使其溶解。
②待固体全部溶解后,将溶液立即转移到容量瓶中。
③继续向容量瓶中加蒸馏水至液面离瓶颈刻度线下___cm时,改用___滴加蒸馏水至溶液的凹液面与刻度线相切。
④用少量蒸馏水洗涤烧杯和___2~3次,每次洗涤的液体都小心转入相应容器中,并轻轻摇匀。
⑤盖好瓶塞,充分摇匀。
以上操作中有错误的一项是___(填序号,下同),这样操作的结果使所配溶液的浓度___(填“偏大”或“偏小”),将其改正后,配制CuSO4溶液的正确操作顺序是___
(3)取上述溶液10mL稀释至50mL,所得溶液中CuSO4的物质的量浓度为___。
(4)下列有关容量瓶的使用方法中,正确的是___(填字母)。
A. 使用容量瓶前检验是否漏水
B. 固体溶解后直接将溶液沿瓶颈倒入容量瓶中
C. 用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复颠倒,摇匀
D. 摇匀后容量瓶内液面下降,继续加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有0.5L某泉水样品,其中含有Ca2+0.02g,请计算:
(1)该泉水样品中Ca2+的物质的量浓度是多少___?
(2)为使该泉水样品中所含的Ca2+全部沉淀,至少应加入Na2CO3的物质的量是多少___?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中含有少量杂质,请在空格中填上适宜的试剂或方法将在杂质除去,并写出相应的方程式(①②写离子方程式,③写化学方程式)。
物质 | 杂质 | 试剂/方法 | 离子/化学方程式 |
①FeCl2 | CuCl2 | ____ | _______ |
②Fe(OH)3 | Al(OH)3 | ____ | _______ |
③Al2O3 | Al(OH)3 | ____ | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含amol金属钠和bmol金属铝的合金投入mg足量水中,完全溶解,无金属剩余,所得溶液密度为dgcm﹣3,下列相关计算式子中错误的是( )
A.NaOH的物质的量:(a﹣b)mol
B.NaAlO2的物质的量浓度:![]() mol/L
mol/L
C.标况下生成H2的体积:![]() L
L
D.参加反应的水的质量:18(a+1.5b)g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
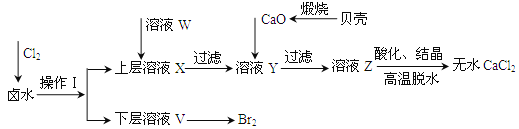
(1)操作Ⅰ使用的试剂是______,所用的主要仪器名称是_____。
(2)加入溶液W的目的是______,用CaO调节溶液Y的pH,可以除去Mg2+,由表中数据可知,理论上可选择的pH最大范围是______,酸化溶液Z时,使用的试剂为______。
开始沉淀时的pH | 沉淀完全时的pH | |
Mg2+ | 9.6 | 11.0 |
Ca2+ | 12.2 | c(OH-)=1.8molL-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,则下列叙述中正确的是( )
A.同温同压下,NA个NO气体与NA个N2和O2的混合气体的体积相等
B.标准状况下,22.4LCCl4所含分子数为NA
C.4℃时,9mL水和标准状况下11.2L氮气含有相同的原子数
D.1.7gH2O2中含有的电子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com