
【题目】已知铅蓄电池的工作原理为Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),现用如图1装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:
2PbSO4(s)+2H2O(l),现用如图1装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:
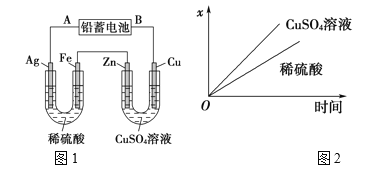
(1)A是铅蓄电池的________极,铅蓄电池正极反应式为:______。
(2)Ag电极的电极反应式是______,该电极的电极产物共________g。
(3)Cu电极的电极反应式是________,CuSO4溶液的浓度_______(填“减小”“增大”或“不变”)。
(4)如图2表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示_______。
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
【答案】负 PbO2+4H++SO42-+2e-===PbSO4+2H2O 2H++2e-===H2↑ 0.4 Cu-2e-===Cu2+ 不变 b
【解析】
已知铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g,则稀硫酸电解池中Fe为阳极,硫酸铜电解池中Cu为阳极,铅蓄电池B为正极,A为负极;
(1)分析可知,A是铅蓄电池的负极;铅蓄电池正极二氧化铅得电子,与硫酸反应生成硫酸铅和水,电极反应式为PbO2+4H++SO42-+2e-=PbSO4+2H2O;
(2)Ag电极为电解池的阴极,氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑;转移0.4mol电子时,生成0.2mol氢气,即0.4g;
(3)Cu电极为阳极,铜失电子生成铜离子,电极反应式为Cu-2e-=Cu2+;溶液中的铜离子在阴极得电子生成铜,则溶液中的铜离子浓度不变;
(4)a.硫酸铜溶液中无气体生成,与图象不符,a错误;
b.各U形管中阳极分别为Fe、Cu,随反应时间的增大,质量逐渐减少,符合图象,b正确;
c.稀硫酸电解池中阴极产生氢气,阴极的质量不变,与图象不符,c错误;
答案为b。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示(已知:PdCl2溶液遇CO能产生黑色的Pd),下列说法错误的是( )
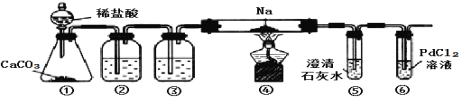
A.装置①可改用启普发生器
B.装置⑤中石灰水变浑浊后,再点燃酒精灯
C.装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D.装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若 m g Na在足量氯气中燃烧,生成固体的质量为(m+3.55)g,则 m g Na与氧气反应,生成的固体的质量为:①2.7g、②3.1g、③3.55g、④3.9g、⑤4.0g( )
A.①②③B.②③④C.③④⑤D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z都是短周期元素,在元素周期表中的位置如图所示:
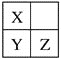
下列有关说法正确的是( )
A. 原子半径:Z>Y>X
B. 氢化物的稳定性:X>Y、Z>Y,可能X>Z
C. 最高价氧化物对应的水化物酸性:Z>Y>X
D. 三种元素形成的简单离子的半径:X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知图一表示的是可逆反应 CO(g)+H2(g)![]() C(s)+H2O(g)-Q(Q>0)的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g)-Q(Q>0)的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)![]() N2O4(g)+Q(Q>0)的浓度(c)随时间 t 的变化情况,下列 说法中正确的是
N2O4(g)+Q(Q>0)的浓度(c)随时间 t 的变化情况,下列 说法中正确的是
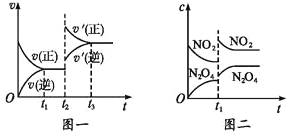
A.图一 t2 时刻改变的条件可能是升高了温度或增大了压强
B.图一 t2 时刻改变的条件可能是通入了 CO 气体
C.图二 t1 时刻改变的条件可能是升高了温度或增大了压强
D.图二 t1 时刻改变的条件是增大压强,则混合气体的平均相对分子质量将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有5×10-3molHIO3 与少量淀粉的溶液中通入H2S,溶液变蓝且有S析出,继续通入H2S,溶液的蓝色褪去,则在整个过程中( )
A. 共得到0.96g硫 B. 通入H2S的体积为336mL
C. 碘元素先被还原后被氧化 D. 转移电子总数为3.0×10-2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁﹣次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣下列有关说法正确的是( )
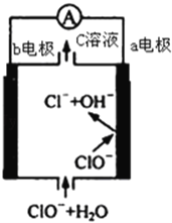
A. 电池工作时,C溶液中的溶质是MgCl2
B. 电池工作时,正极a附近的pH将不断增大
C. 负极反应式:ClO﹣﹣2e﹣+H2O═Cl﹣+2 OH﹣
D. b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结面成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结钩如图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是
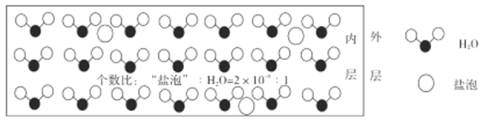
A.海冰内层“盐泡”越多,密度越小
B.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
C.海冰内层NaCl的浓度约为10-4mol/L(设冰的密度为0.9g/cm3)
D.海冰冰龄越长,内层的“盐泡”越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某研究小组探究SO2和Fe(NO3)3溶液的反应。
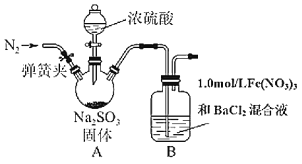
已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,铁架台等夹持仪器已略去,请回答:
(1)用于加入浓硫酸的仪器名称为 ________。装置A中发生的化学方程式为______。
(2)滴加浓硫酸之前要先打开弹簧夹通入一定量的N2,其目的是_____________。
(3)实验中,装置B中产生了白色沉淀,该沉淀的成分是_______,说明SO2具有______性。
(4)分析B中产生白色沉淀的原因:
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
基于观点1,装置B中反应的离子方程式___________。
为证明该观点,应进一步检验生成的新物质,其实验操作及现象为(假定在反应中SO2的量不足_________。
基于观点2,只需将装置B中Fe(NO3)3溶液替换为等体积的下列溶液,在相同的条件下进行实验。应选择的最佳试剂是 _________ (填序号)。
A.0.1 mol·L-1的稀硝酸 B. 1.5 mol·L-1的Fe(NO3)3溶液
C.6.0 mol·L-1的NaNO3和0.2 mol·L-1盐酸等体积混合的混合液
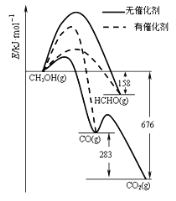
Ⅱ.人们常用催化剂来选择反应进行的方向。 图所示为一定条件下1 mol CH3OH与O2发生反应时生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成_____(填“CO” 、“CO2”或“HCHO”);2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com