
【题目】向含有5×10-3molHIO3 与少量淀粉的溶液中通入H2S,溶液变蓝且有S析出,继续通入H2S,溶液的蓝色褪去,则在整个过程中( )
A. 共得到0.96g硫 B. 通入H2S的体积为336mL
C. 碘元素先被还原后被氧化 D. 转移电子总数为3.0×10-2 NA
【答案】D
【解析】A、HIO3与少量淀粉的溶液中通入H2S,HIO3具有氧化性,能将硫化氢氧化生成硫单质,本身被还原为碘单质,所以溶液变蓝且有S析出,根据得失电子守恒有2HIO3~5H2S~5S,所以5×10-3molHIO3被消耗,最终生成碘离子,得到的硫的质量是![]() ×32g=0.48g,故A错误;B、整个过程中,根据电子守恒、原子守恒,得到HIO3~3H2S~3S~I-,所以5×10-3molHIO3被消耗,就会消耗0.015mol的H2S,标况下体积为336mL,但题目未注明是否为标准状况,故B错误;C、HIO3与少量淀粉的溶液中通入H2S,HIO3具有氧化性,与硫化氢反应生成硫单质和碘单质,H2S被氧化,继续通入H2S,H2S会和碘单质发生反应,碘单质消失,H2S被氧化,故C错误;D、整个过程中,根据电子守恒、原子守恒,得到HIO3~3H2S~3S~I-~6e-,消耗5×10-3molHIO3伴随0.03mol电子转移,转移电子总数为3.0×10-2NA,故D正确;故选D。
×32g=0.48g,故A错误;B、整个过程中,根据电子守恒、原子守恒,得到HIO3~3H2S~3S~I-,所以5×10-3molHIO3被消耗,就会消耗0.015mol的H2S,标况下体积为336mL,但题目未注明是否为标准状况,故B错误;C、HIO3与少量淀粉的溶液中通入H2S,HIO3具有氧化性,与硫化氢反应生成硫单质和碘单质,H2S被氧化,继续通入H2S,H2S会和碘单质发生反应,碘单质消失,H2S被氧化,故C错误;D、整个过程中,根据电子守恒、原子守恒,得到HIO3~3H2S~3S~I-~6e-,消耗5×10-3molHIO3伴随0.03mol电子转移,转移电子总数为3.0×10-2NA,故D正确;故选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺. 
(1)①如图装置用石墨作电极,在一定条件下电解饱和食盐水制取ClO2 . 写出阳极产生ClO2的电极反应式: . ②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为mol.
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2﹣离子.电池工作时正极反应为 .
(3)若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
c/molL﹣1 | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茉酚是一种重要的有机化工原料。利用苯酚合成已二醛[OHC(CH2)4CHO]和尼龙6(![]() )的合成路线如下:
)的合成路线如下:

已知:I.  ;
;
II.  。
。
回答下列问题:
(1)由A制取B的反应类型为_______;C的化学名称为___________。
(2)E的结构简式为____________。
(3)上述流程中合成尼龙6的化学方程式为_____________________。
(4)已二醛与银氨溶液反应的化学方程式为___________________。
(5)已二醛的同分异构休中既含五元环结构,又含“ ” 结构的有_____种(不考虑立体异构);其中核磁共振氢谱有三组峰的结构简式有_________________。
” 结构的有_____种(不考虑立体异构);其中核磁共振氢谱有三组峰的结构简式有_________________。
(6)写出以溴乙烷为原料(其他试剂任选)制备甲醛的合成跻线:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料。
(1)不同温度、压强下.合成该平衡体系NH3的物质的量分数如图 (N2和H2的起始物质的量之比为1:3)。
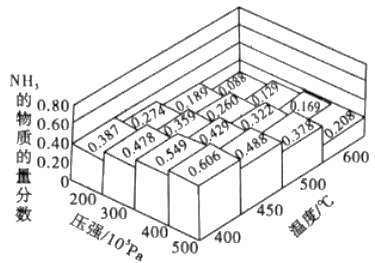
①分析图中数据,升高温度,该反应的平衡常数K值____(填“增大”“减小”或“不变”)。
②如果开始时向密闭容器中投入1.0mol N2 和3.0mol H2,则在500℃、3×107Pa条件下达到平衡时N2 的平衡转化率=_______。(保留两位有效数字)
③液氨和水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为2NH3 ![]() NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
(2)以氨气代替氢气研发氨清洁燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液。该电池负极的电极反应式为_________________。
(3)NH3也是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的NH3转化为氮气除去,其相关反应的热化学方程式如下:
反应I: NH3 (aq)+HClO(aq)=NH2Cl(aq)+H2O(l) △H1=akJ/mol;
反应II :NH2Cl(aq)+HClO(aq)=NHCl2(aq) +H2O(l) △H2=bkJ/mol;
反应III: 2NHCl2(aq) +H2O(l)=N2(g)+HClO( aq)+3HCl( aq) △H3=ckJ/mol。
①2NH3(aq)+3HClO(aq)==N2 (g)+3HCl(aq)+3H2O(l) △H=________kJ/mol
②已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件不变的情况下,改变![]() 对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图所示。a点之前溶液中发生的主要反应为_______(填序号)。
对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图所示。a点之前溶液中发生的主要反应为_______(填序号)。
A.反应I、I I B.反应I

③除氨氮过程中最佳的![]() 值约为______________。
值约为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为长式周期表的一部分,其中的编号代表对应的元素. 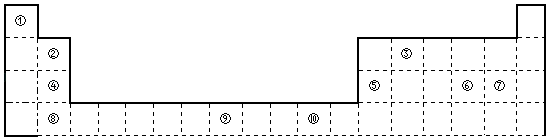
请回答下列问题:
(1)③和①形成的一种5核10电子分子,其立体构型为 , 中心原子杂化方式为 , 属于分子(填“极性”或“非极性”).
(2)元素③和⑦的最高价氧化物对应水化物中酸性较强的是:(填化学式)元素⑥的电负性元素⑦(选填“>”、“=”、“<”=)的电负性.
(3)根据元素周期表分区,元素⑨位于区,其基态原子电子排布式为 .
(4)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质.请写出元素②的氢氧化物与NaOH溶液反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中可以大量共存,加OH-产生沉淀,加H+生成气体的一组离子是( )
A.Na+、Cu2+、CO32-、Cl-
B.Na+、 Cl-、 HCO3-、Mg2+
C.Cl-、NO3-、K+、 Ca2+
D.NH4+、 K+、 H+、 SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B―→C分两步进行:①A+B―→X,②X―→C,反应过程中能量变化如图所示,E1表示反应A+B―→X的活化能。下列有关叙述正确的是( )
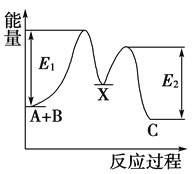
A. E2表示反应X―→C的活化能
B. X是反应A+B―→C的催化剂
C. 反应A+B―→C的ΔH<0
D. 加入催化剂可改变反应A+B―→C的焓变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com