
【题目】如图为长式周期表的一部分,其中的编号代表对应的元素. 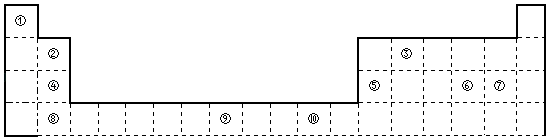
请回答下列问题:
(1)③和①形成的一种5核10电子分子,其立体构型为 , 中心原子杂化方式为 , 属于分子(填“极性”或“非极性”).
(2)元素③和⑦的最高价氧化物对应水化物中酸性较强的是:(填化学式)元素⑥的电负性元素⑦(选填“>”、“=”、“<”=)的电负性.
(3)根据元素周期表分区,元素⑨位于区,其基态原子电子排布式为 .
(4)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质.请写出元素②的氢氧化物与NaOH溶液反应的离子方程式 .
【答案】
(1)正四面体形; sp3;非极性
(2)HClO4;<
(3)d;1s22s22p63s23p63d64s2
(4)Be(OH)2+2OH﹣=BeO22﹣+2H2O
【解析】解:由元素在周期表的位置可知,①为H,②为Be,③为C,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ca,⑨为Fe,⑩为Cu,(1)C和H形成的一种5核10电子分子为CH4,CH4分子中的C原子价层电子对个数是4,则C原子采取sp3杂化,立体构型为正四面体形,分子中正负电荷重心重合,为非极性分子;
所以答案是:正四面体形;sp3;非极性;(2)C的非金属性小于Cl的非金属性,最高价氧化物对应水化物中酸性较强的是HClO4;同周期自左到右电负性减小,所以电负性:S<Cl;
所以答案是:HClO4;<; (3)d区元素包含周期表中3﹣10列元素,上述元素中只有⑨号元素属于d区;为Fe,为26号元素,原子核外有26个电子,根据能量最低原理,其核外电子排布式为:1s22s22p63s23p63d64s2;
所以答案是:d;1s22s22p63s23p63d64s2;(4)元素⑤为Al,Al(OH)3具有两性,元素②为Be,元素⑤与元素②的氢氧化物有相似的性质,故Be(OH)2也具有两性,能与NaOH反应,方程式为:Be(OH)2+2NaOH=Na2BeO2+2H2O,离子方程式为:Be(OH)2+2OH﹣=BeO22﹣+2H2O;
所以答案是:Be(OH)2+2OH﹣=BeO22﹣+2H2O;


科目:高中化学 来源: 题型:
【题目】将CO2转化为甲醇的原理为 CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0.500℃时,在体积为1L 的固定容积的密闭容器中充入1mol CO2、3mol H2 , 测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( ) 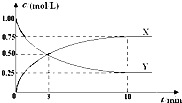
A.曲线X可以表示CH3OH(g) 或H2O(g) 的浓度变化
B.从反应开始到10min时,H2的反应速率v(H2)=0.225mol/(L﹒min)
C.平衡时H2 的转化率为75%
D.500℃时该反应的平衡常数K=3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( ) 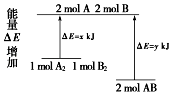
A.该反应的反应热△H=x﹣y kJ/mol
B.断裂1 mol A﹣A键和1 mol B﹣B键放出x kJ能量
C.2 mol AB的总能量高于1 mol A2和1 mol B2总能量
D.该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有5×10-3molHIO3 与少量淀粉的溶液中通入H2S,溶液变蓝且有S析出,继续通入H2S,溶液的蓝色褪去,则在整个过程中( )
A. 共得到0.96g硫 B. 通入H2S的体积为336mL
C. 碘元素先被还原后被氧化 D. 转移电子总数为3.0×10-2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离方法中不正确的是( )
A.利用萃取方法用四氯化碳提取溴水中的溴单质
B.利用蒸馏的方法可以分离沸点相差较大的液体混合物
C.利用分液的方法分离酒精和水
D.利用结晶的方法除去KNO3中的氯化钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空格。
(1)已知拆开1molH-H键、1molCl-Cl键、1molH-Cl键分别需要吸收的能量为436.4kJ、242.7kJ、431.8kJ。则由H2和Cl2反应生成1molHCl需要_____(填“放出”或“吸收”)____kJ的热量。
(2)H2可以在Cl2中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图_____(填“甲”或“乙”)。

(3)已知:H2与Cl2在光照条件下会发生爆炸。同温同压下,反应H2(g)+Cl2(g)=2HCl(g)。在光照和点燃条件下的H_____(填“相等”或“不相等”)。
(4)硅、磷、硫、氯元素的气态氢化物的形成条件和热稳定性如下表所示:
元素符号 | Si | P | S | Cl |
单质与氢气的反应 | 高温下反应 | 磷蒸气与氢气能反应 | 加热时反应 | 光照或点燃时发生爆炸而化合 |
气态氢化物的热稳定性 | 不稳定 | 不稳定 | 受热分解 | 稳定 |
结合元素原子结构等知识,分析以上信息可得出的结论是:同周期非金属元素,随着元素核电荷数的递增,____________________________________,因此,Si、P、S、Cl非金属性依次增强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所发生的反应中,属于酯化反应的是( )
A. 实验室用乙醇、乙酸和浓硫酸反应 B. 将苯滴入溴水中,振荡后水层接近无色
C. 乙烯使酸性高锰酸钾溶液褪色 D. 甲烷与氯气混合,黄绿色消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com