
【题目】实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
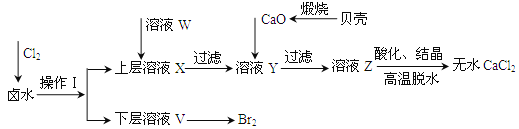
(1)操作Ⅰ使用的试剂是______,所用的主要仪器名称是_____。
(2)加入溶液W的目的是______,用CaO调节溶液Y的pH,可以除去Mg2+,由表中数据可知,理论上可选择的pH最大范围是______,酸化溶液Z时,使用的试剂为______。
开始沉淀时的pH | 沉淀完全时的pH | |
Mg2+ | 9.6 | 11.0 |
Ca2+ | 12.2 | c(OH-)=1.8molL-1 |
【答案】四氯化碳(CCl4) 分液漏斗 除去溶液中的SO42- 11.0≤pH<12.2 盐酸
【解析】
实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,应将混合物中的Mg2+、SO42-等离子除去,操作流程为:卤水中通入氯气,2Br-+Cl2=2Cl-+Br2,单质溴极易溶于有机溶剂,所以可以采用萃取的方法,由流程图可知单质溴在下层,然后再蒸馏可以得到溴单质,向溶液中加入氯化钡中可以将硫酸根离子除去,用CaO调节溶液Y的pH,可以除去Mg2+,加入氧化钙,氧化钙在上层清液中发生反应产生氢氧化钙,镁离子转化成氢氧化镁沉淀,过滤除去,过滤后,得到的溶液Z主要是氯化钙溶液,蒸发浓缩冷却结晶即可得到纯净的无水CaCl2。
(1)氯气具有强氧化性,通入氯气后可以将溶液中的Br-氧化溴单质,2Br-+Cl2=2Cl-+Br2,因为单质溴极易溶于有机溶剂,所以可以采用萃取的方法,萃取的主要仪器是分液漏斗.由流程图可知单质溴在下层,因此该有机溶剂的密度要比水的大且不溶于水,所以该试剂是CCl4,故答案为:CCl4;分液漏斗;
(2)由于SO42-会与Ca2+结合形成微溶性的硫酸钙而影响氯化钙的制备,因此必需除去,应先加入氯化钡溶液使硫酸根离子发生反应产生硫酸钡沉淀,来除去硫酸根离子,由表中数据可知pH大于11时Mg2+沉淀完全,pH大于12.2时,Ca2+开始沉淀,所以理论上可选择pH最大范围是11.0≤pH<12.2;因为不能引入新的杂质,所以酸化溶液Z时,使用的试剂应该为盐酸,故答案为:除去溶液中SO42-;11.0≤pH<12.2;盐酸。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z都是短周期元素,在元素周期表中的位置如图所示:
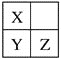
下列有关说法正确的是( )
A. 原子半径:Z>Y>X
B. 氢化物的稳定性:X>Y、Z>Y,可能X>Z
C. 最高价氧化物对应的水化物酸性:Z>Y>X
D. 三种元素形成的简单离子的半径:X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结面成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结钩如图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是
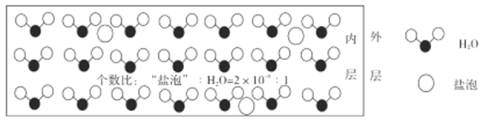
A.海冰内层“盐泡”越多,密度越小
B.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
C.海冰内层NaCl的浓度约为10-4mol/L(设冰的密度为0.9g/cm3)
D.海冰冰龄越长,内层的“盐泡”越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是( )
A.化学反应中电子转移的表示方法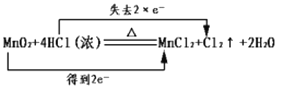
B.离子M2O7x-与S2-能在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+=2M3+ +3S +7H2O,则M2O7x-中M的化合价为+7
C.在常温下发生以下几个反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O②2A2++B2=2A3++2B-③2B-+Z2 =B2+2Z-根据上述反应,可知道氧化性强弱顺序为:XO4->Z2>B2>A3+
D.已知硝酸铵在一定温度下分解为5NH4NO3=4N2↑+2HNO3+9H2O↑,被氧化的元素和被还原的元素的质量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中,A为一种中学化学中常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色实验均为黄色。

(1)写出下列物质的化学式:B___。
(2)以上6个反应中属于氧化还原反应的有___(填写编号)。
(3)写出A →C反应的离子方程式___。
(4)写出B→C反应的离子方程式:___;E→D的化学方程式:___。
(5)加热5.00gD和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31g,则原混合物中D的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质。
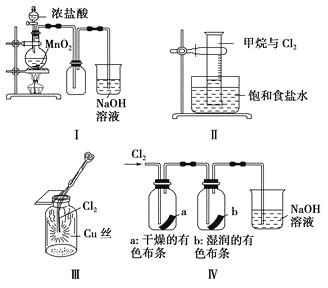
下列说法正确的是
A. Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B. Ⅱ图中:量筒中发生了加成反应
C. Ⅲ图中:生成蓝色的烟
D. Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某研究小组探究SO2和Fe(NO3)3溶液的反应。
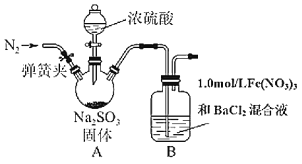
已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,铁架台等夹持仪器已略去,请回答:
(1)用于加入浓硫酸的仪器名称为 ________。装置A中发生的化学方程式为______。
(2)滴加浓硫酸之前要先打开弹簧夹通入一定量的N2,其目的是_____________。
(3)实验中,装置B中产生了白色沉淀,该沉淀的成分是_______,说明SO2具有______性。
(4)分析B中产生白色沉淀的原因:
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
基于观点1,装置B中反应的离子方程式___________。
为证明该观点,应进一步检验生成的新物质,其实验操作及现象为(假定在反应中SO2的量不足_________。
基于观点2,只需将装置B中Fe(NO3)3溶液替换为等体积的下列溶液,在相同的条件下进行实验。应选择的最佳试剂是 _________ (填序号)。
A.0.1 mol·L-1的稀硝酸 B. 1.5 mol·L-1的Fe(NO3)3溶液
C.6.0 mol·L-1的NaNO3和0.2 mol·L-1盐酸等体积混合的混合液
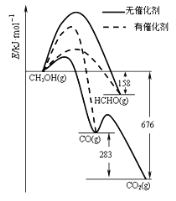
Ⅱ.人们常用催化剂来选择反应进行的方向。 图所示为一定条件下1 mol CH3OH与O2发生反应时生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成_____(填“CO” 、“CO2”或“HCHO”);2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是
2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是
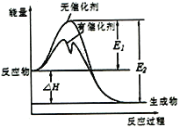
A.该反应的逆反应为放热反应,升高温度可提高活化分子的百分数
B.该反应中,生成物的总键能大于反应物的总键能
C.该反应的反应热为ΔH= E2- E1使用催化剂改变活化能,但不改变反应热
D.500℃、101kPa下,将1molSO2(g)和0.5molO2(g) 置于密闭容器中充分反应生成SO3(g) 放热xkJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-2xkJ·mol-1
2SO3(g)ΔH=-2xkJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |

下列说法正确的是( )
A. 用甲装置过滤时,需不断搅拌
B. 用乙装置将Br-氧化为Br2
C. 丙装置中用正十二烷而不用CCl4,是因为其密度小
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com