
����Ŀ��ij��ѧС���õ���(��ѧʽ![]() )����100mL0.1mol/L��CuSO4��Һ����֪��������ˮ�Ĺ�������������
)����100mL0.1mol/L��CuSO4��Һ����֪��������ˮ�Ĺ�������������
��1�����Ƹ�CuSO4��Һ��������ƿ�Ĺ����___��
��2��ͬѧ�ǽ��������²������뽫�հ״���д������
����������ƽ�ϳƵ���Ӧ�����ĵ������������___�У�������������ˮʹ���ܽ⡣
�ڴ�����ȫ���ܽ����Һ����ת�Ƶ�����ƿ�С�
�ۼ���������ƿ�м�����ˮ��Һ����ƿ���̶�����___cmʱ������___�μ�����ˮ����Һ�İ�Һ����̶������С�
������������ˮϴ���ձ���___2~3�Σ�ÿ��ϴ�ӵ�Һ�嶼С��ת����Ӧ�����У�������ҡ�ȡ�
�ݸǺ�ƿ�������ҡ�ȡ�
���ϲ������д����һ����___(����ţ���ͬ)�����������Ľ��ʹ������Һ��Ũ��___(����ƫ��������ƫС��)���������������CuSO4��Һ����ȷ����˳����___
��3��ȡ������Һ10mLϡ����50mL��������Һ��CuSO4�����ʵ���Ũ��Ϊ___��
��4�������й�����ƿ��ʹ�÷����У���ȷ����___(����ĸ)��
A. ʹ������ƿǰ�����Ƿ�©ˮ
B. �����ܽ��ֱ�ӽ���Һ��ƿ����������ƿ��
C. ��ʳָ��סƿ������һֻ����סƿ�ף�������ƿ�����ߵ���ҡ��
D. ҡ�Ⱥ�����ƿ��Һ���½�������������ˮ���̶���
���𰸡�100 mL �ձ� 1��2 ��ͷ�ι� ������ �� ƫС �٢ڢܢۢ� 0.02mol/L AC
��������
(1)����������Һ���ѡ������ƿ���
(2)����������Һ��һ�㲽��������
(3)����ϡ��ǰ�����ʵ����ʵ���������㣻
(4)��������ƿ��ʹ�÷�����ע��������������Һ���������ķ����������
(1)ijͬѧ������100mL0.1 mol/LCuSO4��Һ��Ӧѡ��100mL����ƿ���ʴ�Ϊ��100 mL��
(2)����������ƽ�ϳƵ���Ӧ�����ĵ��������䵹���ձ��У�������������ˮʹ���ܽ⡣�ۼ���������ƿ�м�����ˮ��Һ����ƿ���̶�����1��2cmʱ�����ý�ͷ�ιܵμ�����ˮ����Һ�İ�Һ����̶������С�������������ˮϴ���ձ��Ͳ�����2~3�Σ�ÿ��ϴ�ӵ�Һ�嶼С��ת����Ӧ�����У�������ҡ�ȡ���������ͭ������ܽ�ʱ���ȹ��̣��ܽ���¶Ƚ��ͣ���Ҫ�ָ������£���˲���ڴ��ڴ�����������������ᵼ��ʹ������Һ�����ƫ��Ũ��ƫС������������Һ��һ�㲽�裺���㡢�������ܽ⡢��ȴת�ơ�ϴ��ת�ơ����ݡ�ҡ�ȡ���ȷ�IJ���˳��Ϊ�٢ڢܢۢݣ��ʴ�Ϊ���ձ���1��2����ͷ�ιܣ����������ڣ�ƫС���٢ڢܢۢݣ�
(3)ȡ������Һ10mLϡ����50mL��ϡ��ǰ�����ʵ����ʵ������䣬��������Һ��CuSO4�����ʵ���Ũ��c=![]() =0.02mol/L���ʴ�Ϊ��0.02mol/L��
=0.02mol/L���ʴ�Ϊ��0.02mol/L��
(4)A.����ƿ�ڲ������ӣ�ʹ������ƿǰ��Ҫ�����Ƿ�©ˮ����A��ȷ��B.�����ܽ����Ҫ�ָ������£��ٽ���Һ�ز�������������ƿ�У���B����C.��ʳָ��סƿ������һֻ����סƿ�ף�������ƿ�����ߵ���ҡ�ȣ�������ȷ����C��ȷ��D.ҡ�Ⱥ�����ƿ��Һ���½����������������ܼ���������ˮ���̶��ߣ���D����ѡAC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ����ֵ���ˮ��Դȱ������ˮ����������Ļ��⡣�����йغ�ˮ������˵����������
A.��ͼ�Ʊ�����ˮ�����������죬���dzɱ�̫��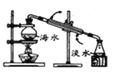
B.��ͼ�Ʊ�����ˮ�Ĺ��̣������������Դ̫���ܣ��ҿɷ������ˮ�е�����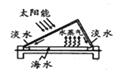
C.��ͼ�����ӽ������Ʊ���ˮ�����������ӽ�������������кͷ�Ӧ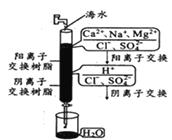
D.��ͼ�������ӽ�����������������Ŀ���ֲ��䣬��Һ�����Ҳ���ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z���Ƕ�����Ԫ�أ���Ԫ�����ڱ��е�λ����ͼ��ʾ��
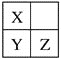
�����й�˵����ȷ����(����)
A. ԭ�Ӱ뾶��Z>Y>X
B. �⻯����ȶ��ԣ�X>Y��Z>Y������X>Z
C. ����������Ӧ��ˮ�������ԣ�Z>Y>X
D. ����Ԫ���γɵļ����ӵİ뾶��X<Y<Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������5��10-3molHIO3 ���������۵���Һ��ͨ��H2S����Һ��������S����������ͨ��H2S����Һ����ɫ��ȥ���������������У� ��
A. ���õ�0.96g�� B. ͨ��H2S�����Ϊ336mL
C. ��Ԫ���ȱ���ԭ������ D. ת�Ƶ�������Ϊ3.0��10-2 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ����������ȼ�ϵ�صĹ���ԭ����ͼ���õ�ط�ӦΪ��Mg+ClO��+H2O�TMg��OH��2+Cl�������й�˵����ȷ���ǣ�������
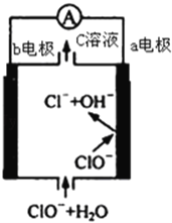
A. ��ع���ʱ��C��Һ�е�������MgCl2
B. ��ع���ʱ������a������pH����������
C. ������Ӧʽ��ClO����2e��+H2O�TCl��+2 OH��
D. b�缫������ԭ��Ӧ��ÿת��0.1mol���ӣ�����������0.1mol Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ְ�ɫ����A��������ˮ����A�����Һ�������¿�ͼ��ʾ��ʵ�飬ʵ������ת����ϵ�����п�ͼ��ʾ��AΪ��������������Ԫ�ػ��ϼ�Ϊ+4������D��ʹƷ����Һ��ɫ������F��ʹʪ��ĺ�ɫʯ����ֽ�������Իش��������⣺

��1��д���������ʻ�ѧʽ��D��__________��F��__________��
��2��д�����з�Ӧ�����ӷ���ʽ��
��A������KMnO4��Һ��Ӧ__________��
��D��������ˮ��__________��
��3��ͨ������Ľ���ڼ���SO42-ʱ��Ӧʹ��__________��
A.�����ữ��BaCl2��Һ B.�����ữ��Ba(NO3)2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǻ�ˮ������ɵ���ˮ������ˮ����ʱ���������������ߵ��η�(����NaClΪ��)��±֭����ʽ����Χ�ڱ���֮�䣬�γ���������������½ṳ��ͼ��ʾ���������ı���ﵽ1�����ϣ��ڻ����ˮΪ��ˮ������������ȷ����
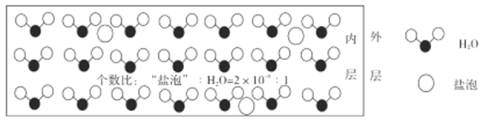
A.�����ڲ���������Խ�࣬�ܶ�ԽС
B.�����ڲ����������ڵ��η���Ҫ��NaCl���ӵ���ʽ����
C.�����ڲ�NaCl��Ũ��ԼΪ10��4mol/L(������ܶ�Ϊ0.9g/cm3)
D.��������Խ�����ڲ����������Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������ԭ��Ӧ��������ȷ���ǣ� ��
A.��ѧ��Ӧ�е���ת�Ƶı�ʾ����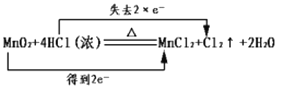
B.����M2O7x����S2-����������Һ�з������·�Ӧ��M2O7x��+3S2��+14H+=2M3+ +3S +7H2O����M2O7x����M�Ļ��ϼ�Ϊ+7
C.�ڳ����·������¼�����Ӧ����16H����10Z����2XO4��=2X2����5Z2��8H2O��2A2����B2=2A3����2B����2B����Z2 =B2��2Z������������Ӧ����֪��������ǿ��˳��Ϊ��XO4����Z2��B2��A3��
D.��֪�������һ���¶��·ֽ�Ϊ5NH4NO3=4N2����2HNO3��9H2O������������Ԫ�غͱ���ԭ��Ԫ�ص�����֮��Ϊ1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g)+O2(g)![]() 2SO3(g)��Ӧ�����������仯��ͼ��ʾ(ͼ��E1��ʾ����Ӧ�Ļ�ܣ�E2��ʾ�淴Ӧ�Ļ�ܡ������й�������ȷ����
2SO3(g)��Ӧ�����������仯��ͼ��ʾ(ͼ��E1��ʾ����Ӧ�Ļ�ܣ�E2��ʾ�淴Ӧ�Ļ�ܡ������й�������ȷ����
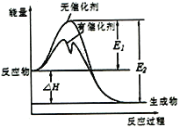
A.�÷�Ӧ���淴ӦΪ���ȷ�Ӧ�������¶ȿ������ӵİٷ���
B.�÷�Ӧ�У���������ܼ��ܴ��ڷ�Ӧ����ܼ���
C.�÷�Ӧ�ķ�Ӧ��Ϊ��H= E2- E1ʹ�ô����ı��ܣ������ı䷴Ӧ��
D.500�桢101kPa�£���1molSO2(g)��0.5molO2(g) �����ܱ������г�ַ�Ӧ����SO3(g) ����xkJ�����Ȼ�ѧ����ʽΪ2SO2(g)+O2(g)![]() 2SO3(g)��H=-2xkJ��mol-1
2SO3(g)��H=-2xkJ��mol-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com