
【题目】下列有关 2 个电化学装置的叙述不正确的是
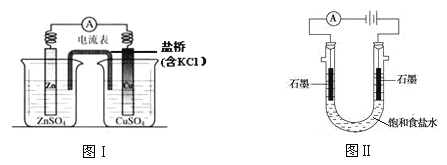
A.图Ⅰ,在不改变总反应的前提下,可用 Na2SO4 替换 ZnSO4,用石墨替换 Cu 棒
B.图Ⅰ,电流形成的完整过程是:负极 Zn-2e-=Zn2+,电子经导线流向正极,正极 Cu2++2e-=Cu
C.图Ⅱ,通电后向两极滴加酚酞,左侧变红
D.图Ⅰ,盐桥中 Cl-向左侧移动,图Ⅱ,溶液中 Cl-向右侧移动
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L-1氨水中滴加0.1 mol·L-1盐酸,溶液中由水电离出的c(H+)随加入盐酸体积的变化如图所示。则下列说法正确的是( )
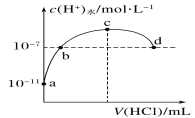
A.c点溶液中,c(NH![]() )=c(Cl-)
)=c(Cl-)
B.a、b之间的任意一点:c(Cl-)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.b、d两点溶液pH均为7
D.b、c、d任意一点都有: c(NH![]() )+c(H+)=c(OH-)+ c(Cl-)
)+c(H+)=c(OH-)+ c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为 0.1 mol/L 的溶液,其 pH 如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.①和③中阴离子的总浓度:c(Cl-) + c(OH-)>c(F-) + c(OH-)
D.④中:c(![]() ) + 2c(
) + 2c(![]() ) + c(H2CO3) 0.1 mol/L
) + c(H2CO3) 0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,其中W元素的原子最外层电子数是内层电子数的2倍。下列说法正确的是
![]()
A.原子半径大小:W>Y>Z
B.X的氢化物与Z的氢化物可以发生反应
C.氧化物对应水化物的酸性:Z>Y>W
D.氢化物的稳定性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸滴定碱时,滴定前读酸式滴定管读数时视线低于水平线,滴定结束时读数正确,这样会使测得的碱溶液的浓度
A.偏高B.偏低C.不受影响D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( )
A.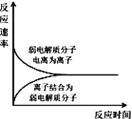 表示弱电解质在水中建立电离平衡的过程
表示弱电解质在水中建立电离平衡的过程
B.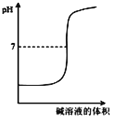 表示强碱滴定强酸的滴定曲线
表示强碱滴定强酸的滴定曲线
C.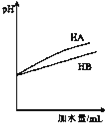 表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
D.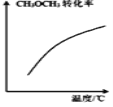 表示密闭容器中
表示密闭容器中![]() 达到平衡后,恒压升高温度过程中,
达到平衡后,恒压升高温度过程中,![]() 的转化率变化趋势
的转化率变化趋势
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.10 mol/L的氨水滴定10.0 mLa mol/L的盐酸,溶液的pH与氨水体积(V)的关系如图所示。已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3·H2O)。下列说法不正确的是( )
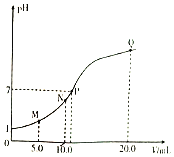
A.a=0.10
B.N、P两点溶液中水的电离程度:N<P
C.M、N两点溶液中NH4+的物质的量之比大于1:2
D.Q点溶液中存在:2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如下图所示,下列说法不正确的是
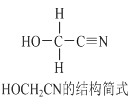
A. HOCH2CN分子中没有手性碳原子
B. 1mol HOCH2CN分子中含有σ键的物质的量为5mol
C. [Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D. HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸中二氧化硫的催化氧化原理为:2SO2(g)+O2(g)![]() 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是

A. 在A、B、C三点时,V(正)=v(逆),在D点时V(正)>v(逆)
B. A、B、C三点的平衡常数一定不相同
C. 升高温度可以加快化学反应速率,有利于平衡向正反应方向移动
D. 一定温度下,保持容器体积不变,向平衡体系中通人稀有气体,压强增大,平衡不移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com