
【题目】25℃时,用0.10 mol/L的氨水滴定10.0 mLa mol/L的盐酸,溶液的pH与氨水体积(V)的关系如图所示。已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3·H2O)。下列说法不正确的是( )
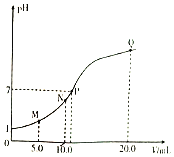
A.a=0.10
B.N、P两点溶液中水的电离程度:N<P
C.M、N两点溶液中NH4+的物质的量之比大于1:2
D.Q点溶液中存在:2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O)
【答案】B
【解析】
A.用 0.10 mol/L的氨水滴定10.0 mL a mol/L的盐酸,N点溶液存在:c(Cl-)=c(NH4+)+c(NH3·H2O),这是NH4Cl的物料守恒式,表明N点恰好生成NH4Cl,为滴定终点,此时消耗氨水的体积为10.0 mL,则根据二者反应关系可知a=0.10,A正确,不符合题意;
B.N点恰好生成NH4Cl,水解促进水的电离,P点时存在过量的氨水,会抑制水的电离,因此N、P两点溶液中水的电离程度:N>P,B错误,符合题意;
C.M点时加入的氨水的体积为5.0 mL,则溶液中起始时存在c(NH4Cl)=c(HCl),由于有HCl的存在,抑制NH4Cl的水解,N点时达到滴定终点,此时溶液中恰好生成NH4Cl,若不考虑水解,M、N两点溶液中NH4+的物质的量之比等于1:2,由于M点处NH4Cl被抑制,N点处NH4Cl水解不受抑制,则M、N两点溶液中NH4+的物质的量之比大于1:2,C正确,不符合题意;
D.Q点时加入氨水的体积为20.0 mL,溶液中起始时存在c(NH4Cl):c(NH3·H2O)=1:1,由质子守恒,c(NH3·H2O)+2c(OH-)=2c(H+)+c(NH4+),,整理可得:2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O),D正确,不符合题意;
故合理选项是B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】a~n10中元素在周期表中的位置如图所示,请回答下列问题:
a | ||||||||
b | c | d | e | |||||
f | g | h | m | n | ||||
…… |
(1)m的阴离子的结构示意图为___。
(2)b的最高价氧化物的化学式为___;用化学方程式表示f、d的单质形成f2d2的过程___。
(3)d、g、n形成的简单离子的半径由大到小的顺序为___(用离子符号表示)。
(4)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。
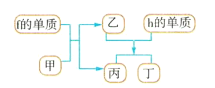
请写出h的单质与乙反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图为实验室制备、收集少量HCl的装置。

① 制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用下图中的 。

② 请解释能用浓硫酸和浓盐酸制备HCl气体的原因 。
③ 装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和 。
(2)以下为苯的取代反应的探究实验。

①按上图所示的装置图连接好各仪器。
②检验装置的气密性。
③在A中加入适量的苯和液溴的混合液体,在B中加入少量铁粉,塞上橡皮塞,打开K1,开始进行反应,放入适量混合液后,关闭K1。
写出B中发生反应的化学方程式 。装置C的作用是 。
④反应结束后,用试管取少量D中的溶液,加入
(描述试剂和现象),则证明B中的取代反应已经发生。
⑤把B中的固液混合物体过滤,分离出液体混合物,按下图方案精制含有苯和溴的溴苯。其中试剂为 ,操作名称为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关 2 个电化学装置的叙述不正确的是
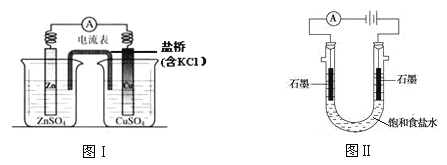
A.图Ⅰ,在不改变总反应的前提下,可用 Na2SO4 替换 ZnSO4,用石墨替换 Cu 棒
B.图Ⅰ,电流形成的完整过程是:负极 Zn-2e-=Zn2+,电子经导线流向正极,正极 Cu2++2e-=Cu
C.图Ⅱ,通电后向两极滴加酚酞,左侧变红
D.图Ⅰ,盐桥中 Cl-向左侧移动,图Ⅱ,溶液中 Cl-向右侧移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁条置于 pH=8.4 的饱和 NaHCO3 溶液中,镁条表面产生气体 a,一段时间后产生白色沉淀b。继续进行如下实验:
Ⅰ.将 a 通过澄清石灰水,变浑浊,继而通过足量 NaOH 溶液,再通入肥皂液,出现气泡,点燃气泡听到爆鸣声;
Ⅱ.向沉淀 b 中加入足量的稀盐酸,沉淀完全溶解,且产生无色气泡。下列说法不正确的是
A.饱和 NaHCO3 溶液中,c(![]() )< c(H2CO3)
)< c(H2CO3)
B.沉淀 b 是 MgCO3
C.气体 a 中含有 CO2 和 H2
D.CO2 可能是 ![]() 水解被促进产生的
水解被促进产生的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定和氮的循环是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K 值。
反应 | 大气固氮N2(g)+O2(g) | 工业固氮N2(g)+3H2(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:人类不适合大规模模拟大气固氮的原因____。
②从平衡视角考虑工业固氮应该选择常温条件,但实际工业生产却选择 500℃左右的高温, 解释其可能的原因_____。
(2)工业固氮反应中,在其他条件相同时,分别测定 N2 的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是_____(填“A”或“B”);比较р1、р2的大小关系_____。
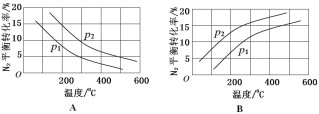
(3)下图是某压强下,N2 与H2 按体积比1∶3投料时,反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。
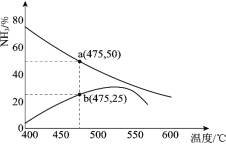
①图中b 点,v(正)_____v(逆)。(填“>”、“=”或“<”)
②图中a 点,容器内气体 n(N2):n(NH3)=_____。
(4)已知:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ·mol-1;2H2(g) +O2(g)
2NH3(g)△H=-92.4kJ·mol-1;2H2(g) +O2(g)![]() 2H2O(l)△H=-575.6kJ·mol-1;近年,又有科学家提出在常温、常压、催化剂等条件下氮气与液态水合成氨气,同时产生氧气的新思路,则该反应的热化学反应方程式为:_____。
2H2O(l)△H=-575.6kJ·mol-1;近年,又有科学家提出在常温、常压、催化剂等条件下氮气与液态水合成氨气,同时产生氧气的新思路,则该反应的热化学反应方程式为:_____。
(5)NH3在一定条件下可被氧化。
已知:ⅰ.4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH=﹣1298kJ/mol
ⅱ.
① 断开 1 mol H-O 键与断开 1 mol H-N 键所需能量相差约_____kJ;
② H-O 键比 H-N 键(填“强”或“弱”)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学过程及其表述正确的是( )
A.向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.由水电离的c(H+)为10-3mol/L的溶液中,Na+、NO3-、SO32-、Cl-一定能大量共存
C.酸碱中和滴定时,盛装标准液的滴定管滴定前无气泡,终点读数时有气泡,导致计算结果偏低
D.可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性2MnO4-+6H++ H2O2=2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。下列判断不正确的是

A.图中对应的e、f单质晶体熔化时克服的是共价键
B.第二电离能:c>d
C.b元素形成的最高价含氧酸易与水分子之间形成氢键
D.单质a、b、f对应的元素以原子个数比1∶1∶1形成的最简单分子中含2个σ键和2个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯高分子材料 PC的透光率好,可制作车、船、飞机的挡风玻璃,以及眼镜镜片、光盘、唱片等, 其合成反应为:
![]()
下列说法不正确的是
A.合成 PC的反应属于缩聚反应B.![]() 的核磁共振氢谱有 4 个吸收峰
的核磁共振氢谱有 4 个吸收峰
C.![]() 和
和![]() 互为同系物D.W 是甲醇
互为同系物D.W 是甲醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com